Introduzione
 Nel precedente articolo sulla impronta ecologica delle terapie farmacologiche, avevamo dedicato un paragrafo al caso particolare della presenza di antibiotici nelle acque reflue e di superfice. Si tratta di un riscontro particolarmente grave e preoccupante perchè contribuisce alla selezione di batteri resistenti agli antibiotici.
Nel precedente articolo sulla impronta ecologica delle terapie farmacologiche, avevamo dedicato un paragrafo al caso particolare della presenza di antibiotici nelle acque reflue e di superfice. Si tratta di un riscontro particolarmente grave e preoccupante perchè contribuisce alla selezione di batteri resistenti agli antibiotici.
Lo sviluppo di resistenza batterica ai farmaci antimicrobici è un problema globale e rappresenta oggi una delle principali minacce emergenti per la salute umana.
Un lavoro pubblicato su The Lancet Global Health, stima un’incidenza di 131 (113-149) infezioni per 100.000 abitanti ed una mortalità attribuibile di 6,44 (5,54–7,48) decessi per 100.000 abitanti. I maggiori oneri sanitari (> 400 DALY per 100.000 abitanti) e i maggiori decessi sono in Italia (10.762).
Nel rapporto europeo del Centro per la prevenzione e il controllo delle malattie (ECDC, 2022) sull’antibiotico - resistenza si evidenzia che in Europa sono oltre 33 mila i decessi all’anno associati ad infezioni antimicrobico-resistenti, di
queste, ben un terzo sono state registrate in Italia, che risulta il Paese con il più elevato consumo di antibiotici e tra i più alti per la percentuale di resistenze ai trattamenti (Fig.1).
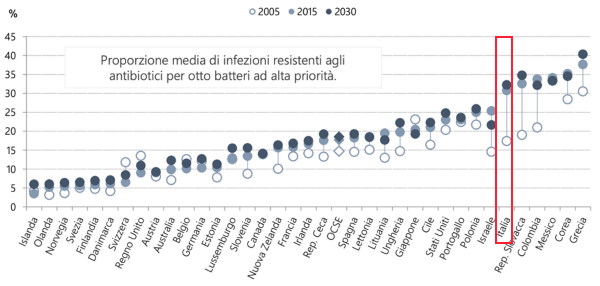
Fig. 1 (Tratta dal Rapporto OECD / OCSE 2018)
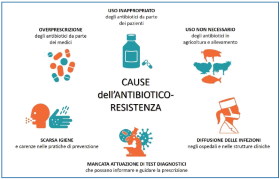
L’antibiotico-resistenza e le sue principali cause
L’antibiotico-resistenza e la sua progressione è anch’essa riconducibile ad una questione ecologica, nella misura in cui si pone in termini di rottura di un equilibrio dinamico tra attività antropica ed ambiente inteso nella sua più ampia accezione di habitat soggetto a cambiamenti anche radicali. Così come l’uomo si è adattato all’ambiente per sopravvivere, attraverso la sua millenaria evoluzione, in analogo modo si comportano i batteri – i più antichi abitanti della Terra – a fronte di condizioni sfavorevoli alla loro vita, però in tempi molto più rapidi, soprattutto se sollecitati di continuo.
Ricordiamo che per antibiotico resistenza, s’intende la capacità acquisita da un microorganismo di sopravvivere a concentrazioni di antibiotico che in precedenza risultavano sufficienti ad inibirne la moltiplicazione o a neutralizzarlo.
Questa proprietà può essere spontanea a seguito di una mutazione genetica non contrastata dalla cellula batterica attraverso le proprie autodifese, esattamente come accade per la specie umana, ma ciò costituisce un evento raro. Diversamente un microrganismo può diventare resistente verso un antibiotico mediante l’attuazione di meccanismi di adattamento (resistenza acquisita). In questo secondo caso, ceppi batterici che erano sensibili a determinati antibiotici, possono sviluppare resistenza mediante modificazioni del loro patrimonio genetico, tramite mutazione, e poi trasferire questa nuova proprietà alla progenie (trasferimento verticale) o mediante acquisizione "in blocco" da parte di altri batteri (anche di specie diversa) di geni che conferiscono resistenza ad uno o più antibiotici (trasferimento orizzontale).
La controffensiva farmacologica alla resistenza è stata quella di produrre nuovi antibiotici in grado di vincere la resistenza opposta dai batteri in una vera e propria escalation che da un lato ha comportato la perdita di efficacia da parte di un numero sempre più elevato di antibiotici, dall’altro la creazione di nuove molecole che stentano però a compensare la velocità con cui si esprime la capacità adattiva degli stessi batteri. Insomma, una vera e propria guerra che si rischia di perdere sul campo e che si aggiungerebbe alla già altrettanto grave crisi prodotta dal cambiamento climatico e dall’inquinamento più in generale. Per questo l’antibiotico resistenza è diventata una minaccia per la salute pubblica decretata dalla stessa OMS, essendo stato dimostrato che nell’ambiente la numerosità e la diversità di geni e batteri resistenti agli antibiotici è strettamente correlata all’impatto causato localmente dalle attività umane.
Ogni anno vengono vendute nel mondo decine di migliaia di tonnellate di farmaci per uso umano e veterinario, ma i due terzi della quantità di antibiotici utilizzati è impiegata nella produzione di alimenti di origine animale che, se da una parte hanno ridotto in modo importante il rischio di infezioni batteriche, dall’altra hanno specularmente elevato quello da antibiotico-resistenza.
Bisogna considerare che più della metà di un principio farmacologico attivo, soprattutto se somministrato per via orale, viene escreto negli scarichi, le cui acque reflue spesso smaltite in modo inadeguato, pur ricorrendo alle attuali tecnologie, finiscono per contaminare l’ambiente.
Anche se non tutti gli antibiotici sono a lungo persistenti, in quanto si degradano abbastanza rapidamente, la loro continua e massiccia immissione in ambiente ne rende una presenza costante. Gli antibiotici raggiungono così le acque reflue urbane, provenienti dall’agricoltura intensiva, dai distretti industriali e, ove presenti, dagli impianti di depurazione, per poi, di solito non totalmente rimossi, immettersi in corsi d’acqua, laghi e mari, oppure in suoli come fanghi di depurazione destinati a concime per i campi. Sono descritti altresì fenomeni di bioaccumulo in piante ed animali che ne amplificano la loro diffusione in ambiente.
L’azione delle autorità regolatorie nazionali e sovranazionali
A livello europeo, la norma sulle Acque (Direttiva 2000/60/CE) ha stabilito già dal 2000, i criteri per proteggere le acque superficiali, costiere e sotterranee e migliorare lo stato degli ecosistemi, nonché promuovere un uso idrico sostenibile basato sulla protezione a lungo termine delle risorse idriche disponibili e contribuire a mitigare gli effetti delle inondazioni e della siccità. La direttiva stabilisce per la prima volta la necessità di definire un elenco progressivamente aggiornato ed implementato di sostanze cosiddette pericolose, per le quali sono fissati valori soglia da monitorare e rispettare. Ma nonostante la norma le quantità di sostanze farmacologicamente attive presenti nelle acque superficiali sono in progressivo aumento.
Alcuni Paesi in particolare hanno iniziato già da tempo ad affrontare l’insorgenza di antimicrobico resistenze con un approccio regolatorio a livello nazionale, come in Norvergia, dove l’uso di antibiotici nella produzione alimentare è molto ridotto e rigorosamente regolato. Non è un caso che questo Paese presenti i migliori dati sullo sviluppo di resistenza antimicrobica in campo umano. In Svezia, è stato messo a punto un modello per la classificazione dei farmaci in base alle loro caratteristiche ecotossicologiche che serve al medico come guida alla prescrizione, a parità di target microbico, di privilegiare quelli maggiormente ecocompatibili.
In Svizzera sono state introdotte nei depuratori, tecnologie e procedure di trattamento particolarmente avanzate che impediscono la selezione di specie microbiche sopravvissute ai trattamenti precedenti e quindi ancor maggiormente resistenti. L’adozione di misure naturali (competizione, predazione) e i tempi di trattamento più lunghi, selezionano comunità microbiche più simili a quelle naturali, in cui i batteri di origine antropica hanno pochissime possibilità di sopravvivere.
L’orizzonte in cui ci si deve muovere, non può che essere quindi quello della One Health, la salute globale, dove ricerca e prevenzione sono chiamate a coinvolgere già in fase di progettazione il settore umano, veterinario, e ambientale, semplicemente perché le interconnessioni dell’habitat in cui viviamo non offrono alternative possibili per la sopravvivenza dell’uomo.
L’OMS dal canto suo, ha affrontato l’argomento piu su un piano sanitario, cercando di perseguire una maggiore appropriatezza nella prescrizione/consumo di antibiotici sia in ospedale che sul territorio per minimizzare lo sviluppo di resistenze, attraverso la diffusione delle strumento AWaRe.
Lo strumento AWaRe
Lo strumento AWaRe (dalle iniziali di Acces, Watch e Reserve) è stato sviluppato dall’OMS Essential Medicines List e proposto a tutti i Paesi, nel 2019 per contenere la crescente resistenza e rendere l’uso di antibiotici più sicuro ed efficace. Il dispositivo classifica gli antibiotici in tre gruppi – Access, Watch e Reserve – e specifica quali antibiotici utilizzare per le infezioni più comuni e gravi, quali dovrebbero essere disponibili in qualsiasi momento nel sistema sanitario e quelli che devono essere utilizzati con parsimonia o conservate e usato solo come ultima risorsa.
Gruppo Access
Questo gruppo include antibiotici che hanno attività contro un'ampia gamma di agenti patogeni suscettibili comunemente incontrati mentre mostrano anche un potenziale di resistenza inferiore rispetto agli antibiotici negli altri gruppi. Il gruppo Access comprende 48 antibiotici, 19 dei quali sono inclusi individualmente nell'elenco dei farmaci essenziali dell'OMS come opzioni di trattamento empirico di prima o seconda scelta per specifiche sindromi infettive.
Gruppo Watch
Questo gruppo include antibiotici che hanno un potenziale di resistenza più elevato e include la maggior parte degli agenti con la massima priorità tra gli antimicrobici di importanza critica per la medicina umana e/o antibiotici che sono a rischio relativamente alto di selezione della resistenza batterica. Gli antibiotici di questo gruppo dovrebbero avere la priorità come obiettivi chiave dei programmi di gestione e monitoraggio. Il gruppo comprende 110 antibiotici, 11 dei quali sono inclusi individualmente nell'elenco dei farmaci essenziali dell'OMS come opzioni di trattamento empirico di prima o seconda scelta per specifiche sindromi infettive.
Gruppo Reserve
Questo gruppo comprende antibiotici e classi di antibiotici che dovrebbero essere riservati al trattamento di infezioni confermate o sospette dovute a organismi multiresistenti. Gli antibiotici del gruppo, dovrebbero essere trattati come opzioni di "ultima risorsa", quindi, accessibili, ma il loro uso dovrebbe essere adattato a pazienti e contesti altamente specifici, quando tutte le alternative hanno fallito o non sono adatte. Questi medicinali potrebbero essere protetti e classificati come obiettivi chiave dei programmi di gestione nazionali e internazionali che prevedono il monitoraggio e la segnalazione dell'utilizzo, per preservarne l'efficacia. Sono in totale 22 gli antibiotici classificati come gruppo di riserva. Sette antibiotici del gruppo sono elencati individualmente nell'elenco dei farmaci essenziali dell'OMS.
L’elenco completo dei gruppi AWaRe con le relative molecole e le specifiche indicazioni di prima e seconda scelta, sono pubblicati dall’OMS al seguente link: https://aware.essentialmeds.org/list
La campagna dell’OMS mira ad aumentare la percentuale del consumo globale di antibiotici del gruppo Access ad almeno il 60% e a ridurre l’uso degli antibiotici più a rischio di resistenza dai gruppi Watch e Reserve. L’uso degli antibiotici Access riduce il rischio di resistenza perché sono antibiotici a “spettro ristretto”. Sono anche meno costosi perché sono disponibili in formulazioni generiche.
Attualmente, l’OMS stima che oltre il 50% degli antibiotici in molti paesi vengano utilizzati in modo inappropriato come per il trattamento di virus o l’uso di antibiotici sbagliati, cioè con uno spettro più ampio del necessario, contribuendo così alla diffusione della resistenza antimicrobica.
Una delle preoccupazioni più urgenti è la diffusione di batteri gram-negativi resistenti, tra cui Acinetobacter, Escherichia coli e Klebsiella pneumoniae. Questi batteri, che sono comunemente osservati in pazienti ospedalizzati, causano infezioni come polmonite, infezioni ematiche, infezioni della ferita o del sito chirurgico e meningite. Quando gli antibiotici smettono di funzionare in modo efficace, sono necessari trattamenti più costosi e ricoveri ospedalieri prolungati, con pesanti ripercussioni sui budget sanitari.
Aifa e lo strumento AWaRe
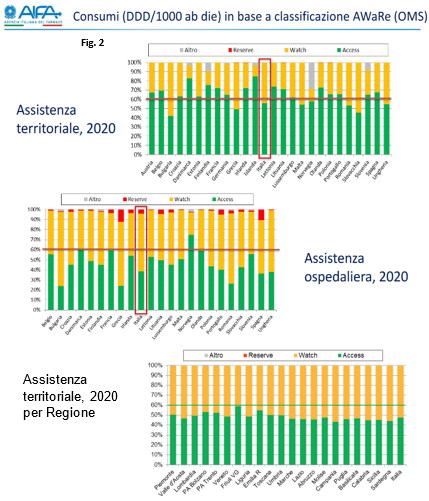
Nel rapporto sull’uso degli antibiotici in Italia, pubblicato a marzo di quest’anno da Aifa e relativo ai dati del 2020, sono stati utilizzati nell’analisi anche le informazioni sulla classificazione AWaRe proposta da OMS (fig.2).
Nel merito possiamo osservare come nell’assistenza territoriale l’Italia non raggiunga la percentuale minima di antibiotici Access prevista da OMS e dai dati regionali, emerge che l’unica Regione che si avvicina a questa soglia è il Friuli VG. Il dato sull’utilizzo ospedaliero, teoricamente più facilmente controllabile, è invece piuttosto sconfortante e testimonia le difficoltà dell’applicazione dell’antimicrobial stewardsheep in ospedale e in generale dell’appropriatezza prescrittiva degli antibiotici.
Conclusioni
Le strategie di lotta all’antibiotico resistenza si compongono di azioni collettive e individuali che non possono prescindere dalla stringente necessità di un rispetto rigoroso dell’ambiente e dell’ecosistema di cui facciamo parte.
Come abbiamo osservato, l’aumento dei tassi di resistenza è già da ora una grave minaccia per la salute dei soggetti più fragili nel territorio ma soprattutto in ambito ospedaliero e richiede interventi immediati e sinergici da parte dei governi, delle autorità regolatorie nazionali e internazionli e della comunità scientifica nel contesto di un approccio realmente olistico (One Health).
Come riconosce invece la relazione della Corte dei conti europea n° 21/2019, la lotta complessiva dei Paesi della UE contro i batteri multiresistenti, ha registrato finora scarsi progressi. Anche se l’intervento dell’UE ha permesso di conseguire alcuni risultati positivi, specie in campo veterinario, la Corte ritiene che pochi elementi dimostrano una riduzione dell’onere sanitario determinato dalla resistenza antimicrobica. C’è pertanto ancora molto da fare, soprattutto per quei Paesi, come l’Italia che hanno dati maggiormente preoccupanti.
In sostanza, lo sviluppo delle resistenze batteriche, è riconducible essenzialmente a due aspetti:
- al riversamento nell’ambiente di grandi quantità di antibiotici non adeguatamente ed efficacemente contrastato dagi impianti di depurazione delle acque reflue;
- all’uso inappropriato di sostanze antimicrobiche negli ambiti della salute umana, dell’agricoltura e delle produzioni zootecniche.
Pertanto gli interventi dovrebbero concentrarsi, nel primo caso, migliorando il trattamento delle acque reflue (come è stato fatto in Svizzera) preceduto dall’abbattimento dei livelli residui dei farmaci presenti nelle acque di provenienza ospedaliera, prima di farle confluire nella rete fognaria comune da inviare ai trattamenti di depurazione.
Nel secondo caso, per l’agricoltura e la produzione zootecnica, occorre ridurre al minimo l’impiego di antibiotici con interventi normativi e una maggiore vigilanza sul loro utilizzo in questo ambito.
Riguardo invece alla salute umana, gli interventi in capo alle autorità regolatorie sanitarie nazionali e regionali, ma anche alle associazioni degli operatori sanitari e ai singoli professionisti, devono tendere a migliorare la gestione e l’appropriatezza nella prescrizione/indicazione degli antibiotici in ospedale e nei territori, anche attraverso i seguenti interventi:
- miglioramento delle condizioni igieniche nelle strutture sanitarie, promuovendo tra l’altro l’igiene delle mani e degli ambienti ospedalieri;
- introduzione e ampliamento dei programmi di stewardship volti a favorire un utilizzo più prudente degli antibiotici per porre fine a decenni di prescrizioni eccessive e non appropriate;
- formazione e sensibilizzazione dei prescrittori sugli obbiettivi e sulle azioni previste dal piano nazionale di contrasto all’antimicrobicoresistenza (Pncar);
- adeguamento della reportistica periodica sulla prescrizione nei reparti ospedalieri e verso i medici di famiglia, introducendo specifici indicatori sull’appropriatezza delle prescrizioni di antibiotici (es. il sistema AWaRe utilizzato da Aifa nella sua analisi sul consumo di antibiotici);
- ricorso a test diagnostici rapidi per accertare la natura batterica o virale delle infezioni;
- organizzazione di campagne di sensibilizzazione rivolte ai cittadini sui rischi che comportano l’utilizzo non necessario degli antibiotici e sul loro corretto smaltimento, con il coinvolgimento delle farmacie di comunità.
In assenza di nuovi investimenti significativi nello sviluppo di nuove molecole, il miglioramento dell’uso degli antibiotici è una delle azioni chiave necessarie per frenare l’ulteriore emergere e la diffusione delle resistenze. La resistenza antimicrobica è una sorta di “pandemia invisibile”, che rischia di colpire la popolazione più fragile, con l’emergere di infezioni che non sono più curabili dall’attuale armamentario antibiotico. Occorre salvaguardare gli antibiotici di ultima linea per garantire la cura e la prevenzione delle gravi infezioni.
Si ringraziano per i contributi, Aldo Procacci, Mauro De Rosa, Dario Maratea.
Bibliografia
- ElizabethTemkin, NogaFallach, JonatanAlmagor et al.
Estimating the number of infections caused by antibiotic-resistant Escherichia coli and Klebsiella pneumoniae in 2014: a modelling study
The Lancet Global Heath Volume 6, Issue 9, September 2018, Pages e969-e979
https://www.sciencedirect.com/science/article/pii/S2214109X1830278X - Rapporto OCSE - OECD Health Statistics 2022 – Antimicrobial resistance
https://www.oecd.org/health/antimicrobial-resistance.htm - Antimicrobial resistance in the EU/EEA (EARS-Net) - Annual Epidemiological Report for 2020
ECDC Surveillance report 25 Jul 2022 Publication series: Antimicrobial resistance surveillance in Europe
https://www.ecdc.europa.eu/en/publications-data/antimicrobial-resistance-eueea-ears-net-annual-epidemiological-report-2020 - Istituto Superiore di Sanità
AR-ISS: sorveglianza nazionale dell’Antibiotico-Resistenza. Dati 2020
https://www.iss.it/documents/20126/0/RIS-1_2021.pdf/af6da4cc-0f57-3800-68ca-c5f6c05479c0?t=1637230397225 - Ministero della Salute
Dati di vendita dei medicinali veterinari contenenti sostanze antibiotiche
https://www.alimenti-salute.it/notizia/ministero-salute-dati-vendita-medicinali-veterinari-contenenti-sostanze-antibiotiche-0 - Istituto Superiore di Sanità - EpiCentro
Antibiotico-resistenza: impatto clinico ed economico e interventi
https://www.epicentro.iss.it/antibiotico-resistenza/impatto-clinico-economico-interventi - Istituto Superiore di Sanità - Approccio ambientale all’antibiotico-resistenza
Rapporti ISTISAN 21/3. https://www.iss.it/documents/20126/0/21-3+web.pdf/ad2152a4-5871-18ad-df26-4164980faf90?t=1616404472633 - ECDC - WHO
Rapporto 2022. Antimicrobial resistance surveillance in Europe 2020 data
https://www.quotidianosanita.it/allegati/allegato1622551.pdf - WHO releases the 2019 AWaRe Classification Antibiotics
https://www.who.int/news/item/01-10-2019-who-releases-the-2019-aware-classification-antibiotics - AIFA. Antibiotico-resistenza: un rischio globale che richiede strategie condivise
https://www.aifa.gov.it/-/antibiotico-resistenza-un-rischio-globale-che-richiede-strategie-condivise - AIFA. Rapporto Nazionale sull’uso degli antibiotici in Italia - Anno 2020.
https://www.aifa.gov.it/documents/20142/1664282/Rapporto_Antibiotici_2020.pdf - C.Sbaffi, E.Olmastroni, E.Tragni
Antibiotic resistance: causes, consequences, research strategies, and health policies to counteract it
SEFAP - Servizio di Epidemiologia e Farmacologia Preventiva, Dipartimento di Scienze Farmacologiche e Biomolecolari, Università degli Studi di Milano. http://www.sefap.it/web/upload/GIFF2021-2_25_39.pdf - Corte dei Conti Europea. Relazione speciale n. 21/2019
Lotta alla resistenza antimicrobica: nonostante i progressi compiuti nel settore veterinario, permane la minaccia sanitaria per l’UE. https://www.eca.europa.eu/it/Pages/NewsItem.aspx?nid=12998
