PREMESSA
L’arrivo dei primi vaccini contro il virus SARS-CoV-2 rappresenta una svolta fondamentale nella lotta alla pandemia: il mondo scientifico ha fornito in un lasso di tempo inimmaginabile, anche solo un anno fa, un’arma importante per contrastare l’avanzamento della pandemia.
Ma non è l’unica, ci sono interessanti dati preliminari anche sul fronte terapeutico.
Il lavoro scientifico di Weinreich et al. (1) riporta i risultati di uno studio condotto su pazienti con infezione precoce trattati con una combinazione di due anticorpi monoclonali
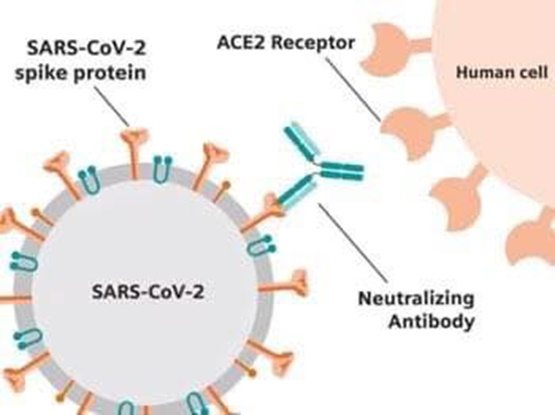
neutralizzanti e non competitivi, Casirivimab e Imdevimab (REGN-COV2 prodotto da Regeneron). Target di entrambi gli anticorpi è il dominio di legame del recettore della proteina spike SARS-CoV2, tale legame previene l’ingresso del virus nelle cellule umane attraverso il recettore dell’angiotensina 2 (2,3).
Lo studio clinico multicentrico, randomizzato, in doppio cieco e controllato con placebo, ha arruolato 275 pazienti non ospedalizzati risultati positivi al test entro le 72 ore precedenti all’arruolamento ovvero entro 7 giorni dall’insorgenza di una sintomatologia correlabile al Covid-19. I pazienti assegnati in modo casuale in un rapporto 1: 1: 1, hanno ricevuto o una singola infusione endovenosa da 2,4 g a 8 g di REGN-COV2 o placebo. Gli endpoint principalmente valutati sono stati la variazione rispetto al basale della carica virale dal giorno 1 al giorno 7 e la percentuale di pazienti che hanno richiesto almeno una visita medica correlata al Covid-19 fino al giorno 29. I soggetti nel braccio dello studio che hanno ricevuto una delle due dosi di REGN-CoV2, hanno mostrato livelli di RNA di SARS-Cov-2 inferiori rispetto a quelli trovati nei soggetti del gruppo placebo. Un numero ristretto di soggetti ha avuto necessità di una visita medica entro il periodo di folllow-up a 29 giorni: prevalentemente soggetti allocati nel gruppo placebo.
Nello studio condotto da Chen et al., (4) sono stati, invece, valutate tre dosi (700 mg, 2800 mg e 7000 mg) di un singolo anticorpo monoclonale, il Bamlanivimab (LY-CoV555 prodotto da Eli Lilly and Company) (5), avente come target terapeutico, sempre, il dominio di legame del recettore della proteina spike SARS-CoV2 . Lo studio è stato condotto su 452 pazienti non ospedalizzati risultati positivi al SARS-CoV2 entro 4 giorni dall'insorgenza dei sintomi, di questi 309 pazienti hanno ricevuto Bamlanivimab e 143 hanno ricevuto placebo. Tre giorni dopo l’avvio dello studio in entrambi i gruppi è stata rilevata una riduzione della carica virale, tale riduzione è stata maggiore nel gruppo trattato con Bamlanivimab. Nei 29 giorni, 14 sono i soggetti che hanno richiesto ospedalizzazione: 5 nel gruppo trattato e 9 nel gruppo placebo.
In entrambi gli studi, nessun beneficio è stato dimostrato nei soggetti ospedalizzati e con malattia avanzata.
Recentemente, lo studio clinico di fase 2-3 condotto da Gottlieb et. al(6) ha valutato l'efficacia e gli effetti avversi della monoterapia con Bamlanivimab e della terapia di associazione Bamlanivimab ed Etesevimab in pazienti ambulatoriali con COVID-19 da lieve a moderato di recente diagnosi, l'endpoint primario, la variazione media dal basale della carica virale in scala logaritmica al giorno 11, non era significativamente diverso per i gruppi in monoterapia con Bamlanivimab rispetto al gruppo placebo, ma era significativamente diverso per il gruppo in terapia di combinazione Bamlanivimab ed Etesevimab rispetto al gruppo placebo. Sono, comunque, necessari ulteriori studi clinici sulla valutazione del beneficio clinico degli anticorpi neutralizzanti antispike nei pazienti con COVID-19 come end point primario.
I risultati riportati da Weinreich e Chen e dai loro colleghi hanno fornito informazioni chiave che hanno indotto la Food and Drug Administration (FDA) ha rilasciare l'autorizzazione all'uso di emergenza di Bamlanivimab (7) e della combinazione Casirivimab-Imdevimab (8) in adulti e bambini di età superiore ai 12 anni, affetti da Covid-19 lieve o moderata e che sono ad alto rischio di malattia grave.
Ulteriori trials clinici, sono in corso, per valutare l’uso a scopo preventivo di questi anticorpi monoclonali, in soggetti che non possono ricevere la vaccinazione o che necessitano di profilassi (9). Sono in corso, attualmente, anche studi per migliorare l’emivita di questi farmaci e valutare vie di somministrazione alternative (intramuscolare o sottocutanea) (10).
Sebbene si stia ancora studiando la popolazione di pazienti affetti da COVID-19 con un migliore profilo rischio/beneficio per entrambi i trattamenti, i primi dati suggeriscono un maggiore beneficio nei pazienti ad alto rischio, compresi quelli di età superiore ai 65 anni, con un sistema immunitario compromesso o con determinate condizioni mediche inclusa l'obesità(11). Gli anticorpi monoclonali sono destinati ai pazienti a cui è stato recentemente diagnosticato il COVID-19 non gravi e non ospedalizzati, ma con alta probabilità di peggioramento della patologia. Il fattore tempo è molto importante per questo trattamento, deve essere effettuato il test ai primi sintomi e bisogna somministrare l'infusione il prima possibile.
Le evidenze dimostrano che gli anticorpi monoclonali rimangono efficaci contro la nuova variante SARS-CoV-2 chiamata B.1.1.7 (segnalata per la prima volta nel Regno Unito). Tuttavia, alcune mutazioni possono causare cambiamenti nella proteina spike che potrebbero interferire con l'efficacia degli anticorpi monoclonali attualmente disponibili.
LO STATO DELL’ARTE DELL’AUTORIZZAZIONE EMA
In considerazione della innovatività terapeutica di questi prodotti, il comitato per i medicinali per l'uomo (CHMP) dell'EMA sta esaminando i dati disponibili sull'uso degli anticorpi monoclonali Casirivimab, Imdevimab, Bamlanivimab ed Etesevimab per il trattamento di pazienti con COVID-19 che non richiedono l'integrazione di ossigeno e che sono ad alto rischio di progredire ad uno stato grave di patologia COVID- 19 (12) .
La decisione del CHMP di avviare la revisione ciclica si basa sui risultati preliminari che indicano un effetto benefico del medicinale nel ridurre la quantità di virus presente nel sangue (carica virale) in pazienti con COVID-19 non ospedalizzati. Tuttavia, l'EMA non ha ancora valutato lo studio completo ed è troppo presto per trarre conclusioni sul rapporto beneficio/rischio del medicinale.
I risultati preliminari di entrambi gli studi indicano, inoltre, che le combinazioni hanno ridotto la carica virale (quantità di virus nella parte posteriore del naso e della gola) più del placebo e hanno portato a un minor numero di visite mediche e ricoveri correlati a COVID-19.
Il comitato esaminerà anche l'uso del solo Bamlanivimab sulla base di uno studio che ha indicato che la monoterapia con Bamlanivimab può ridurre la carica virale e fornire un beneficio clinico (13).
La revisione ciclica continuerà fino a quando non saranno disponibili sufficienti prove a sostegno di una domanda formale di autorizzazione all'immissione in commercio.
L'EMA valuterà la conformità del medicinale agli usuali standard di efficacia, sicurezza e qualità. Sebbene non sia ancora possibile prevedere la tempistica complessiva, la procedura dovrebbe essere più breve rispetto a quella ordinaria, grazie al tempo risparmiato durante la revisione ciclica.
Il CHMP sta conducendo due revisioni separate (una per la combinazione Casirivimab / Imdevimab e un'altra per Bamlanivimab / Etesevimab). Il direttore esecutivo dell'EMA ha richiesto entrambe le revisioni ai sensi dell'articolo 5, paragrafo 3, del regolamento 726/2004 in seguito a discussioni preliminari con la task force pandemica dell'EMA COVID-19 (COVID-ETF), che riunisce esperti di tutta la rete normativa europea dei medicinali per fornire consulenza sviluppo, autorizzazione e monitoraggio della sicurezza di medicinali e vaccini per COVID-19.
Le revisioni sono condotte dal Comitato per i medicinali per uso umano (CHMP) dell'EMA, responsabile per le questioni riguardanti i medicinali per uso umano, che emetterà un parere scientifico nel più breve tempo possibile. I pareri scientifici vengono quindi pubblicati per gli Stati membri dell'UE che possono prenderli in considerazione quando prendono decisioni sull'uso di questi medicinali a livello nazionale prima del rilascio delle autorizzazioni all'immissione in commercio formali.
GLI ANTICORPI MONOCLONALI IN ITALIA
Il Comitato Tecnico Scientifico di AIFA, riunitosi in seduta straordinaria nei giorni 2-3 e 4 febbraio 2021, pur considerando l’immaturità dei dati e la conseguente incertezza rispetto all’entità del beneficio offerto dagli anticorpi monoclonali della Regeron e della Eli Lilly and Company ha ritenuto che in via straordinaria e in considerazione della situazione emergenziale, possa essere opportuno offrire comunque un’opzione terapeutica ai soggetti non ospedalizzati che, pur avendo una malattia lieve/moderata risultano ad alto rischio di sviluppare una forma grave di COVID-19 con conseguente aumento delle probabilità di ospedalizzazione e/o morte. Tali farmaci saranno resi disponibili con procedura straordinaria e a fronte di una rivalutazione continua sulla base delle nuove evidenze disponibili, dell’arrivo di nuovi anticorpi monoclonali o altri farmaci, e delle eventuali decisioni assunte in merito da EMA (14).
In particolare, l’Agenzia Italiana del Farmaco (AIFA) ha ritenuto opportuno promuovere e supportare, anche in Italia, uno studio clinico randomizzato al fine di verificare se gli anticorpi monoclonali possano rappresentare una reale opzione terapeutica nella prevenzione della progressione del Covid-19 nei pazienti in fase precoce di malattia (15).
La popolazione candidabile al trattamento dovrà essere rappresentata unicamente da soggetti di età >12 anni, positivi per SARS-CoV-2, non ospedalizzati per COVID-19, non in ossigenoterapia per COVID-19, con sintomi di grado lieve-moderato di recente insorgenza (e comunque da non oltre 10 giorni) e presenza di almeno uno dei fattori di rischio (o almeno 2 se uno di essi è l’età >65 anni) elencati in tabella. 
Se le premesse dovessero essere confermate, l’uso di questi farmaci potrebbe sensibilmente ridurre gli esiti negativi da infezione da SARS-CoV-2, il numero di ospedalizzazioni e la conseguente pressione sul sistema sanitario.
RIFLESSIONI
In Italia dopo la presentazione dei dati, vi sono state posizioni differenziate a proposito dell’utilizzo di questi nuovi prodotti.
Vale la pena di portare la riflessione su come si può enfatizzare l’effetto “positivo” con il quale attivare gli effetti mediatici che subito si sono scatenati sui giornali: ancora una volta assistiamo ad una presentazione dei dati in termini di riduzione del rischio relativo piuttosto che di riduzione del rischio assoluto è il classico specchietto per le allodole.
Lasciamo ai nostri lettori distinguere tra “riduzione dei ricoveri dell’80% perché i ricoveri sono passati dal 5,8% all’1%”, rispetto alla riduzione in termini assoluti pari 4,8% senza effetti sulla mortalità.
Corrispondono a due modi di dire la stessa cosa in maniera corretta perché la riduzione dal 5,8% all’1% equivale ad una riduzione del rischio relativo dell’80% ma l’effetto in termini assoluti è la riduzione ogni 100 trattati da 5,8% all’1% in termini assoluti 4,8% ricoveri in meno senza una dimostrazione di riduzione della mortalità.
Questi due modi di rappresentare, correttamente, il dato ma con una grande differenza di percezione dell’effetto (dire -80% dei ricoveri ha un impatto molto differente del dire -4,8%), è quello che consente di far percepire la prudenza di AIFA come la solita sottrazione di opportunità terapeutiche perchè sono ad alto costo. LA realtà è molto diversa.
BIBLIOGRAFIA
- Weinreich DM, Sivapalasingam S, Norton T, et al. REGN-COV2, a neutralizing antibody cocktail, in outpatients with Covid-19. N Engl J Med 2021;384:238-251.
- Baum A, Fulton BO, Wloga E, et al. Antibody cocktail to SARS-CoV-2 spike protein prevents rapid mutational escape seen with individual antibodies. Science 2020;369:1014-1018.
- Hansen J, Baum A, Pascal KE, et al. Studies in humanized mice and convalescent humans yield a SARS-CoV-2 antibody cocktail. Science 2020;369:1010-1014.
- Chen P, Nirula A, Heller B, et al. SARS-CoV-2 neutralizing antibody LY-CoV555 in outpatients with Covid-19. N Engl J Med 2021;384:229-237.
- Jones BE, Brown-Augsburger PL, Corbett KS, et al. LY-CoV555, a rapidly isolated potent neutralizing antibody, provides protection in a non-human primate model of SARS-CoV-2 infection. October 1, 2020
- Robert L. Gottlieb, Ajay Nirula, Peter Chen :Effect of Bamlanivimab as Monotherapy or in Combination With Etesevimab on Viral Load in Patients With Mild to Moderate COVID-19.– JAMA 2021
- Food and Drug Administration. Coronavirus (COVID-19) update: FDA authorizes monoclonal antibodies for treatment of COVID-19. FDA news release, November 21, 2020 (https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-authorizes-monoclonal-antibodies-treatment-covid-19. opens in new tab).
- Food and Drug Administration. Coronavirus (COVID-19) update: FDA authorizes monoclonal antibodies for treatment of COVID-19. FDA news release, November 21, 2020 (https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-authorizes-monoclonal-antibodies-treatment-covid-19. opens in new tab).
- Marovich M, Mascola JR, Cohen MS. Monoclonal antibodies for prevention and treatment of COVID-19. JAMA 2020;324:131-132.
- Renn A, Fu Y, Hu X, Hall MD, Simeonov A. Fruitful neutralizing antibody pipeline brings hope to defeat SARS-Cov-2. Trends Pharmacol Sci 2020;41:815-829.
- C. Lloyd; T.N. Gandhi; L. A. Petty: Monoclonal Antibodies for COVID-19. JAMA. Published online February 5, 2021
- https://www.ema.europa.eu/en/news/ema-reviewing-data-monoclonal-antibody-use-covid-19
- SARS-CoV-2 Neutralizing Antibody LY-CoV555 in Outpatients with Covid-19. N Engl J Med 2021; 384:229-237
- https://www.aifa.gov.it/web/guest/-/aifa-pubblica-parere-cts-su-anticorpi-monoclonali
- https://www.aifa.gov.it/web/guest/-/studio-su-anticorpi-monoclonali-per-il-covid-19-aifa-proroga-i-termini-del-bando
