Premessa
E’ ben noto a tutti che verso la fine della scorsa primavera noti esponenti del mondo scientifico italiano abbiano, forse incautamente, fatto dichiarazioni  sulla probabile “morte clinica” del virus SARS-CoV-2. Al di là delle personali posizioni e strumentalizzazioni che si sono susseguite a queste dichiarazioni, non è nostro intento entrare nel merito scientifico/clinico di tali valutazioni. Tuttavia, appare evidente un dato di fatto: il virus non è scomparso e la “seconda ondata” è arrivata. Anche durante la fine del primo lockdown, influenti esponenti del mondo scientifico e regolatorio come ad esempio Walter Ricciardi, consigliere
sulla probabile “morte clinica” del virus SARS-CoV-2. Al di là delle personali posizioni e strumentalizzazioni che si sono susseguite a queste dichiarazioni, non è nostro intento entrare nel merito scientifico/clinico di tali valutazioni. Tuttavia, appare evidente un dato di fatto: il virus non è scomparso e la “seconda ondata” è arrivata. Anche durante la fine del primo lockdown, influenti esponenti del mondo scientifico e regolatorio come ad esempio Walter Ricciardi, consigliere
del Ministro della Salute Roberto Speranza per l'emergenza COVID-19, nonché rappresentante italiano presso il consiglio dell'OMS, aveva avanzato tale ipotesi, ovvero l’arrivo della cosiddetta “seconda ondata” in autunno. L’Italia cosa ha fatto? O meglio, gli italiani come si sono comportati?
Durante tutto il periodo estivo abbiamo assistito ad immagini di spiagge prive di opportuno distanziamento sociale, di porti balneari pieni di turisti, di discoteche aperte, e quant’altro. Ora, che ci fosse il naturale desiderio di ritornare alla vita normale è comprensibile e noi tutti abbiamo ripreso chi più chi meno a fare viaggi e a passare l’estate in maniera più rilassata. Il dato che a nostro avviso è preoccupante, non è stato tanto la voglia di ritornare alla normale quotidianità ma quanto quello di abbassare il livello di guardia contro un virus che a detta di tutti sarebbe ritornato a far male. E qui ritorna il tema della PREVENZIONE, quella che molto probabilmente è mancata, oppure è di difficile applicazione duratura quando non si impongono rigide misure di controllo e di contenimento a tutela della salute pubblica. PREVENZIONE, proprio perché ad oggi una cura risolutiva ancora non esiste, di cui forse si intravede qualche ipotesi più consistente con anticorpi monoclonali e vaccini: si, ma quando? E soprattutto, cosa dicono le evidenze scientifiche su questi nuovi prodotti annunciati da tempo?
I trattamenti ad oggi disponibili raccomandati dall’Agenzia Italiana del Farmaco
Il sito web dell’AIFA riporta una serie di schede informative con opportune raccomandazioni sul corretto utilizzo di alcune opzioni di trattamento per pazienti COVID-positivi.1 Senza entrare nel merito di ogni singola scheda informativa, da una valutazione narrativa di ognuna, si evince come per ognuna delle schede non esiste una specifica raccomandazione con un parere robusto (oppure secondo alcuni sistemi di valutazione positiva forte), tale per cui si possa affermare che pazienti COVID-positivi possono essere ad oggi curati in maniera efficace e risolutiva.
Alcune molecole avevano fatto scalpore, a tal punto da avviare, giustamente, importati studi clinici a riguardo e ad autorizzarne l’utilizzo off-label (es. tocilizumab). Sfortunatamente, i dati non hanno riportato risultati soddisfacenti, tanto da scoraggiarne la rimborsabilità e l’utilizzo.
Remdesivir, il farmaco più discusso: non convincono i risultati del megatrial OMS sulla sua efficacia.
Non convincono i risultati sull’efficacia di remdesivir, di idrossiclorochina, della combinazione lopinavir/ritonavir e dei regimi a base di interferone emersi dal megatrial “Solidarity”.2,3 A detta dell’OMS, infatti, i risultati “ad interim” indicano un piccolo o inesistente effetto sulla mortalità a 28 giorni o sul decorso ospedaliero da COVID-19. Anche l'Unione Europea aveva scommesso sul remdesivir. La Commissione Europea ha annunciato nel mese di ottobre 2020 un contratto per garantire forniture aggiuntive del farmaco antivirale per un massimo di 500.000 pazienti.4 Nonostante i dubbi sulla sua efficacia, remdesivir è stato il primo farmaco a ricevere l'approvazione dell'UE (nome commerciale Veklury®) per il trattamento di casi gravi della malattia causati dal nuovo coronavirus.5
Costi economici e accordi negoziali con Gilead
Oltre al dilemma scientifico, c’è anche quello economico, che non è secondario. Gli USA e l’UE hanno già fatto accordi con Gilead per le forniture del farmaco e adesso la “mannaia” OMS se non pregiudica le forniture, sicuramente mette in discussione molte certezze che si sono venute a creare. Ora non è chiaro se Gilead rivedrà il prezzo del medicinale (2.070 euro per ciclo terapeutico) alla luce degli ultimi dati. In Italia, in virtù del preliminare successo del remdesivir, l’AIFA ha giustamente introdotto un opportuno registro di monitoraggio per verificarne sia l’appropriatezza d’uso sia gli esiti dell’impiego.6 Grande lavoro per i servizi farmaceutici regionali, le farmacie ospedaliere e i reparti, per gestire, anche logisticamente, tali scorte che sono in misura molto limitata rispetto al numero di pazienti.
Anticorpi monoclonali: quali le evidenze7
Si elencano di seguito gli studi clinici in corso (studi di fase III) nello sviluppo di anticorpi monoclonali per il trattamento del COVID-19:
- LY-CoV555 (Eli Lilly and Company)
Il 28 ottobre la rivista scientifica New England Journal of Medicine ha pubblicato i risultati preliminari dello studio di fase 2 SARS-CoV-2 Neutralizing Antibody LY-CoV555 in Outpatients with Covid-19 (ClinicalTrials.gov, n. NCT04427501) sull’uso degli anticorpi monoclonali nel trattamento di pazienti affetti da Covid-19 di grado lieve o moderato. Lo studio ha coinvolto 452 pazienti ambulatoriali con Covid-19 lieve o moderato di recente diagnosi, assegnati in randomizzato alla somministrazione endovenosa di un anticorpo monoclonale neutralizzante LY-CoV555 in una delle tre dosi (700 mg, 2800 mg o 7000 mg) o di una sostanza placebo allo scopo di valutare la variazione, rispetto al basale, della carica virale a 11 giorni dalla somministrazione (outcome primario). Di seguito si riportano i 3 dati meritevoli d’interesse: 1) sebbene la carica virale al giorno 11 sia stata inferiore nel gruppo sperimentale rispetto al gruppo placebo, tale end-point è stato considerato non clinicamente rilevante, in considerazione del naturale decorso della malattia; 2) è stato riscontrato un effetto positivo del trattamento con LY-CoV555 sulla sintomatologia (giorno 3) senza differenze sostanziali osservate tra i tre dosaggi; 3) al giorno 29, la percentuale di pazienti ricoverati è stata dell'1,6% nel gruppo LY-CoV555 e del 6,3% nel gruppo placebo. In un'analisi post hoc focalizzata su sottogruppi ad alto rischio (un'età ≥65 anni o un BMI ≥35), la percentuale di ospedalizzazione è stata del 4,2% nel gruppo LY-CoV555 e del 14,6% nel gruppo placebo. Se questi risultati saranno confermati da ulteriori analisi dello studio, LY-CoV555 potrebbe diventare un trattamento utile per l'uso di emergenza in pazienti con Covid-19 di recente diagnosi.
- REGN-COV2 (Sponsor Regeneron Pharmaceuticals; studio coordinato dall’Università di Oxford)
Gli anticorpi monoclonali che compongono il farmaco REGN-COV2 sono attualmente oggetto di studio in due trial clinici di fase 2/3 e di fase 3.- Lo studio RECOVERY COVID-19 phase 3 trial to evaluate Regeneron’s REGN-COV2 investigational antibody cocktail in the UK, coordinato dall’Università di Oxford ha l’obiettivo di valutare gli effetti della somministrazione di REGN-COV2 (REGN10933 + REGN10987) rispetto allo standard di cura, a 28 giorni dall’arruolamento. E’ previsto l’arruolamento di almeno 2.000 pazienti assegnati in modo casuale a ricevere REGN-COV2 più il normale standard di cura, confrontati con almeno 2.000 pazienti che ricevono solo lo standard di cura. Lo standard di cura varia a seconda dell'ospedale.
Altri endpoint includono l'impatto sulla degenza ospedaliera e la necessità di ventilazione. - Lo studio di fase 3Study Assessing the Efficacy and Safety of Anti-Spike SARS CoV-2 Monoclonal Antibodies for Prevention of SARS CoV-2 Infection Asymptomatic in Healthy Adults Who Are Household Contacts to an Individual With a Positive SARS-CoV-2 RT-PCR Assay (NCT04452318) valuterà la capacità di REGN-COV2 di prevenire l'infezione tra persone non infette che hanno avuto una stretta esposizione a un paziente COVID-19 (contatti stretti). Tre sono gli obiettivi principali dello studio: 1) valutare l'efficacia di REGN-COV2 rispetto al placebo nella prevenzione dell'infezione sintomatica da SARS-CoV-2 confermata dalla tecnica della Reverse transcriptase-polymerase chain reaction (RT-qPCR); 2) valutare l'efficacia di REGN-COV2 rispetto al placebo nella prevenzione dell'infezione SARS-CoV-2 asintomatica o sintomatica confermata da RT-qPCR; 3) valutare la sicurezza e la tollerabilità dopo la somministrazione sottocutanea rispetto al placebo.
- Lo studio RECOVERY COVID-19 phase 3 trial to evaluate Regeneron’s REGN-COV2 investigational antibody cocktail in the UK, coordinato dall’Università di Oxford ha l’obiettivo di valutare gli effetti della somministrazione di REGN-COV2 (REGN10933 + REGN10987) rispetto allo standard di cura, a 28 giorni dall’arruolamento. E’ previsto l’arruolamento di almeno 2.000 pazienti assegnati in modo casuale a ricevere REGN-COV2 più il normale standard di cura, confrontati con almeno 2.000 pazienti che ricevono solo lo standard di cura. Lo standard di cura varia a seconda dell'ospedale.
- VIR-7831 (Sponsor, Vir Biotechnology, Inc.; collaborator, GlaxoSmithKline).
Lo studio di fase 2/3 VIR-7831 for the Early Treatment of COVID-19 in Outpatients (COMET-ICE) (NCT04545060) ha l’obiettivo di valutare sicurezza, tollerabilità, efficacia e farmacocinetica dell’anticorpo monoclonale VIR-7831 per il trattamento precoce del COVID-19 in pazienti ad alto rischio di ospedalizzazione. E’ previsto l’arruolamento di 1.360 soggetti di età pari o superiore a 18 anni ad alto rischio di progressione di COVID-19. I partecipanti, inoltre, devono avere un risultato del test SARS-CoV-2 positivo e una saturazione di ossigeno ≥94% nell'aria ambiente e avere sintomi COVID-19 per un periodo inferiore o uguale a 5 giorni dall'insorgenza dei sintomi.
- LY3819253 (Eli Lilly and Company; Collaborator, National Institute of Allergy and Infectious Diseases (NIAID) AbCellera Biologics Inc.
Sempre in fase 3 è lo studio A Study of LY3819253 (LY-CoV555) in Preventing SARS-CoV-2 Infection and COVID-19 in Nursing Home Residents and Staff (BLAZE-2) (NCT04497987), che ha l’obiettivo di valutare se l’anticorpo monoclonale LY3819253 sia in grado di prevenire l'infezione SARS-CoV-2 e la malattia COVID-19 in residenti e personale presente in strutture di assistenza a lungo termine negli Stati Uniti (strutture infermieristiche qualificate, comunemente denominate case di cura e strutture di residenza assistita) con un alto rischio di esposizione a SARS-CoV- 2.
Vaccino COVID-19: le sperimentazioni in atto8
Si elencano di seguito le sperimentazioni in atto (studi di fase III) nello sviluppo di vaccini per la prevenzione dell’infezione da SARS-CoV-2:
- CoV2.S (numero identificativo: NCT04505722; Sponsor, Janssen Vaccines & Prevention B.V.)
A causa dell’insorgenza di una patologia (non prevista) in uno dei partecipanti, l’Azienda farmaceutica Johnson & Johnson ha annunciato la momentanea sospensionedello studio di fase 3 riguardante il vaccino ricombinante Ad26.COV2.S (ENSEMBLE).
- Ad5-nCoV (numero identificativo: NCT04526990; Sponsor, CanSino Biologics Inc,; Partner, Beijing Institute of Biotechnology).
Lo studio di fase 3 Phase III Trial of A COVID-19 Vaccine of Adenovirus Vector in Adults 18 Years Old and Above, randomizzato, in doppio cieco, controllato con placebo, ha lo scopo di valutare negli adulti con età ≥ 18 anni l'efficacia, la sicurezza e l'immunogenicità del nuovo vaccino ricombinante (Ad5-nCoV) contro il coronavirus che utilizza un adenovirus (di tipo 5, non replicante) per trasportare il materiale genetico che codifica per la proteina Spike di SARS-CoV-2. Il programma di immunizzazione prevede la somministrazione di una sola dose di vaccino per via intramuscolare nel deltoide. E’ prevista l’arruolamento di 4000 soggetti (2000 nel gruppo sperimentale e 2000 nel gruppo placebo).
- AZD1222 (numero identificativo: NCT04516746; Sponsor, AstraZeneca; Partner, Iqvia Pty Ltd).
Riprende la sperimentazione clinica sul vaccino anti-SARS-CoV-2 sviluppato da AstraZeneca e dall'Università di Oxford, dopo essere stata momentaneamente sospesa a causa di un effetto collaterale segnalato in un paziente del Regno Unito. Dopo un’indagine effettuata da parte di un comitato indipendente, gli esperti e la Medicines Health Regulatory Authority (MHRA), l’ente regolatorio britannico, hanno concluso che è sicuro riprendere la sperimentazione clinica. Oxford e AstraZeneca hanno rifiutato di divulgare qualsiasi informazione medica "per motivi di riservatezza dei partecipanti". Durante l’interruzione della somministrazione di nuove dosi di vaccino, è continuato regolarmente il monitoraggio dei soggetti a cui il vaccino era già stato somministrato. Complessivamente sono circa 18.000 i soggetti a cui è stato somministrato il vaccino AZD1222.
- CoronaVac (numero identificativo: NCT04582344; Sponsor, Health Institutes of Turkey).
E’ in fase III lo studio Clinical Trial For SARS-CoV-2 Vaccine (COVID-19)riguardante il vaccino inattivato contro SARS-CoV-2 "CoronaVac”, prodotto da Sinovac Research & Development Co., Ltd. (link: ). Si tratta di uno studio clinico randomizzato, in doppio cieco, controllato con placebo, condotto in adulti di età compresa tra 18 e 59 anni. Lo scopo di questo studio è valutare l'efficacia, la sicurezza e l'immunogenicità del vaccino “CoronaVac”. E’ previsto l’arruolamento di 13.000 partecipanti assegnati a ricevere due dosi di vaccino sperimentale, o placebo, al tempo 0 e 14 giorni dalla prima somministrazione. Lo studio sarà condotto su due coorti separate: 1) la prima sarà formata da operatori sanitari che rappresenteranno il gruppo ad alto rischio (K-1); 2) la seconda coorte sarà composta da persone a rischio normale (K-2). L'analisi preliminare di sicurezza è prevista al completamento del programma vaccinale (2 dosi) in 1.300 volontari (gruppo K-2).
- Gam-COVID-Vac Lyo (numero identificativo: NCT04530396; Sponsor, Gamaleya Research Institute of Epidemiology and Microbiology, Health Ministry of the Russian Federation; Partner, Government of the city of Moscow).
Lo studio clinico multicentrico di fase III Clinical Trial of Efficacy, Safety, and Immunogenicity of Gam-COVID-Vac Vaccine Against COVID-19 (RESIST), randomizzato, in doppio cieco, controllato con placebo ha l’obiettivo di valutare l’efficacia, l’immunogenicità e la sicurezza del vaccino vettoriale Gam-COVID-Vac, basato sull’adenovirus umano. E’ previsto l’arruolamento di 40.000 soggetti di età superiore ai 18 anni, randomizzati (3:1) in due gruppi: 1) un gruppo di riferimento di 10.000 volontari riceveranno il placebo; 2) un gruppo di studio di 30.000 volontari riceveranno il vaccino sperimentale Gam-COVID-Vac al tempo 0 e a 21 (±2) giorni dalla prima somministrazione. Ciascun soggetto parteciperà alla sperimentazione per 180 ± 14 giorni dopo la somministrazione della prima dose di vaccino/placebo.
- mRNA 1273 (numero identificativo: NCT04470427; Sponsor, ModernaTX, Inc.; Partner, Biomedical Advanced Research and Development Authority National Institute of Allergy and Infectious Diseases (NIAID).
Il 14 luglio è iniziato lo studio in fase 3 A Study to Evaluate Efficacy, Safety, and Immunogenicity of mRNA-1273 Vaccine in Adults Aged 18 Years and Older to Prevent COVID-19 è progettato per valutare principalmente l'efficacia, la sicurezza e l'immunogenicità di mRNA-1273 per prevenire COVID-19 fino a 2 anni dopo la seconda dose di mRNA-1273. I partecipanti riceveranno 1 iniezione intramuscolare (IM) di 100 microgrammi (ug) di mRNA-1273 il giorno 1 e il giorno 29 e saranno confrontati con il gruppo che riceverà il placebo (iniezione di cloruro di sodio allo 0,9%, soluzione salina normale).
- Nanoparticle Vaccine With Matrix-M1TMAdjuvant (EudraCT Number: 2020-004123-16; Sponsor, Novavax).
Lo studio di fase III A Phase 3, Randomised, Observer-Blinded, Placebo-Controlled Trial to Evaluate the Efficacy and Safety of a SARS-CoV-2 Recombinant Spike Protein Nanoparticle Vaccine (SARS-CoV-2 rS) with Matrix-M1™ Adjuvant in Adult Participants 18-84 Years of Age in the United Kingdom, randomizzato, in cieco, controllato con placebo, ha lo scopo di valutare l'efficacia e la sicurezza di un vaccino con nanoparticelle proteiche spike ricombinanti SARS-CoV-2 (SARS-CoV-2 rS) con adiuvante Matrix-M1 ™ in partecipanti adulti di età compresa tra 18 e 84 anni nel Regno Unito. E’ previsto l’arruolamento di 9.000 partecipanti (randomizzati in due gruppi) assegnati a ricevere due dosi di vaccino sperimentale, o placebo, al tempo 0 e a 21 giorni dalla prima somministrazione.
- PROFISCOV (numero identificativo: NCT04456595; Sponsor, Butantan Institute; Partner, Sinovac Life Sciences Co., Ltd.).
E’ attualmente in fase III Clinical Trial of Efficacy and Safety of Sinovac's Adsorbed COVID-19 (Inactivated) Vaccine in Healthcare Professionals (PROFISCOV) la sperimentazione clinica per valutare l'efficacia e la sicurezza del vaccino anti COVID-19 (inattivato, adsorbito) negli operatori sanitari. Lo studio sarà in doppio cieco controllato con placebo con partecipanti assegnati in modo casuale 1: 1 ai bracci placebo e vaccino. Il programma di immunizzazione prevede iniezioni intramuscolari di due dosi con un intervallo di 14 giorni. Per valutare la sicurezza e immunogenicità, i partecipanti saranno divisi in due gruppi di età, adulti (18-59 anni) e anziani (60 anni e oltre). Il database sulla sicurezza ha come obiettivo quello di rilevare reazioni avverse con frequenza di 1: 1000 o superiore negli adulti e di 1: 500 negli anziani. Tutti i partecipanti saranno seguiti fino a 12 mesi. L'analisi preliminare dell'efficacia sarà avviata raggiungendo il numero target di 150 casi.
- Vero cell (numero identificativo: NCT04560881; Sponsor, Laboratorio Elea Phoenix S.A.; Partner, Beijing Institute of Biological Products Co., Ltd.).
In fase di reclutamento anche lo studio clinico di fase III Clinical Trial to Evaluate the Efficacy, Immunogenicity and Safety of the Inactivated SARS-CoV-2 Vaccine (COVID-19), randomizzato, in doppio cieco, controllato con placebo, che ha l’obiettivo di valutare l'efficacia, l'immunogenicità e la sicurezza del vaccino inattivato SARS-CoV-2 (Vero Cell). Lo studio prevede il coinvolgimento di 3.000 partecipanti sani di età compresa tra 18 e 85 anni, assegnati a ricevere in modo casuale (randomizzato) due dosi di vaccino sperimentale Vero Cell, o placebo, al tempo 0 e dopo 21 giorni dalla prima somministrazione.
Il vaccino Pfizer: bene, speriamo in ulteriori conferme
Vaccini di questo tipo utilizzano la sequenza del materiale genetico del nuovo coronavirus, ossia l'acido ribonucleico (RNA), il messaggero molecolare che contiene le istruzioni per costruire le proteine del virus.9 L'obiettivo è somministrare direttamente l'mRNA che controlla la produzione di una proteina contro la quale si vuole scatenare la reazione del sistema immunitario, che nel caso specifico è la proteina Spike (utilizzato dal virus per agganciare le cellule sane e invaderle). La proteina Spike è stata una delle prime a essere individuata, è ben nota e si è osservato che il sistema immunitario umano è in grado di riconoscerla.
I dati dello studio di fase III che stanno facendo discutere tutti i media, hanno riportato una risposta immunitaria potenzialmente protettiva (efficace al 90%). In pratica, nello studio sono stati arruolati 44.000 soggetti divisi in 2 gruppi: metà vaccinati con il vaccino anti-COVID, metà con placebo (ovviamente i partecipanti allo studio non sanno a quale gruppo appartengono). Due dosi sono state somministrate ai partecipanti e una settimana dopo la seconda (e ultima) dose di vaccino, i ricercatori hanno contato 94 casi di COVID-19 (verificati maggiormente tra i non vaccinati). Per terminare lo studio bisogna arrivare a 164 infettati, e le cose potrebbero anche cambiare.10
L’anticipazione sulla stampa
Recentemente un noto editore e commentatore scientifico ha pubblicato un articolo critico sulle modalità di questa Azienda di “anticipare” con un comunic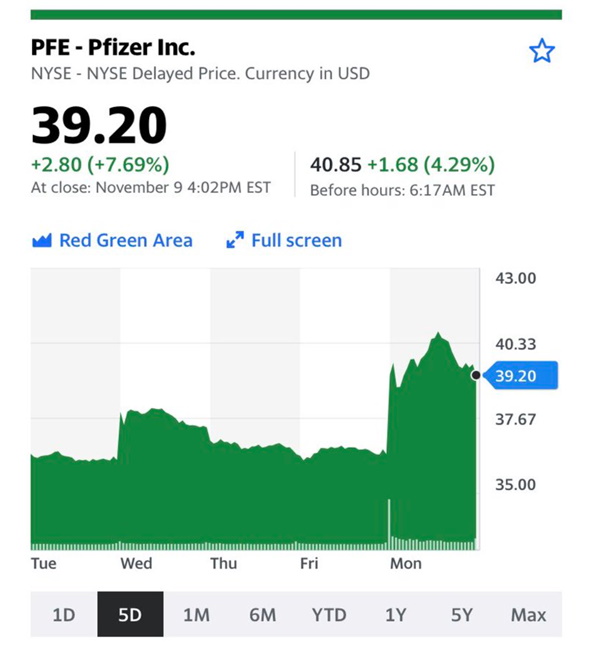 ato ripreso dalla stampa mondiale la notizia di efficacia (al 90% su dati preliminari), quasi come se fosse lo “sbarco sulla luna di Neil Amstrong”.11
ato ripreso dalla stampa mondiale la notizia di efficacia (al 90% su dati preliminari), quasi come se fosse lo “sbarco sulla luna di Neil Amstrong”.11
La dichiarazione che ne è seguita da parte del il direttore dei National Institutes of Infectious Diseases, Anthony Fauci: “The results are really quite good, I mean extraordinary” ha fatto fare un bel balzo al mercato azionario. Risultato: il valore di Pfizer è cresciuto del 7,7 per cento. L’anticipazione di questi dati del tutto preliminari permetterà a Pfizer di fare domanda alla Food and Drug Administration per l’approvazione accelerata del vaccino già intorno alla seconda decade di novembre 2020.
Probabilmente ci sarebbe voluta una maggiore prudenza nelle dichiarazioni sia di Fauci che di Pfizer in quanto i dati “si riferiscono ad un numero ancora abbastanza modesto di persone arruolate nello studio (62 poi diventate 94 a distanza di pochissime ore)”. Inoltre ci sono dubbi sulla reale efficacia che genericamente è stata dichiarata al 90% e alla reale possibilità di portare il vaccino negli ambulatori medici che non dispongono di frigoriferi per la detenzione di prodotti che devono stare a -70°.
Riflessioni finali e conclusioni
Che non ci siano trattamenti risolutivi è ben noto sia dai dati di ricovero ospedaliero sia dall’aumento dei casi giornalieri di nuovi positivi cui stiamo assistendo in questi giorni. Senza voler puntare il dito contro qualcuno, anche perché pensiamo non sia atteggiamento corretto in questo periodo, riteniamo che in queste situazioni la PREVENZIONE continui ad essere l’unico strumento in nostro possesso per cercare di arginare situazioni emergenziali alle quali - inevitabilmente - si potrà trovare soluzione con un altro lockdown nazionale, salvo che i dati dei prossimi giorni non riportino risultati incoraggianti e sufficienti a evitare un’altra chiusura nazionale e che quindi si possa continuare a diversificare le Regioni italiane in zone rosse, zone arancioni e zone gialle.
Future terapie sono all’orizzonte ma, sinceramente, non sappiamo quanto l’orizzonte sia vicino e, soprattutto, se le terapia saranno disponibili in breve tempo per tutta la popolazione mondiale. Nel corso dei mesi precedenti, diversi studi hanno mostrato dati incoraggianti che, purtroppo, si sono mostrati inconsistenti. Basti pensare all’utilizzo del tocilizumab, oppure allo stesso remdesivir che risulta essere l’unica terapia in atto, sicuramente utile, e approvata dalle Autorità regolatorie americane, europee e italiane, ma a quanto pare dai dati preliminari pubblicati dall’OMS non risolutivo.
Da ultimo, l’annuncio del vaccino Pfizer ha facendo sicuramente scalpore a livello borsistico con relativo guadagno dei titoli dell'azienda. Speriamo sia di buon auspicio anche per le attività di PREVENZIONE dell’infezione virale!
Ma noi crediamo nelle evidenze, nei dati scientifici robusti (e non negli annunci ad alto effetto mediatico), che possono essere rappresentativi per l’intera popolazione. Attendiamo conseguentemente ulteriori conferme e soprattutto siamo interessati a sapere per quanto tempo un soggetto dopo la somministrazione del vaccino rimanga immunizzato, nonché quali siano i dati sul profilo di sicurezza che derivano dagli studi.
Per concludere, sappiamo che la corsa alle terapie risolutive, per la cura dei pazienti già infettati e per i cittadini che intendono proteggersi, evidentemente, potranno rispettivamente curare o prevenire l’infezione per tutto il mondo; quindi, inevitabilmente, questo investimento delle Autorità sanitarie porterà anche ingenti guadagni per le Aziende farmaceutiche che per prime ci faranno uscire da questa pandemia.
Porre questioni di sostenibilità del Servizio Sanitario Nazionale appare fuorviante e fuori luogo in quanto oggi risulta necessario fare tutti gli sforzi possibili (oltre a quelli già fatti fino ad ora) per uscire da questa emergenza sanitaria.
Le nostre raccomandazioni, che tra l’altro abbiamo portato avanti anche negli editoriali precedenti, sono quelle di mantenere alta la guardia e di proseguire con un’attenta PREVENZIONE basata su distanziamento sociale, utilizzo di mascherina e disinfezione delle mani. Ad oggi, nessuna cura ci può proteggere ma dobbiamo contare solo sul nostro senso civico e rispetto per la salute dell’intera popolazione.
* Nuovo Ospedale S. Stefano di Prato; afferente alla UOC Politiche del Farmaco - Azienda USL Toscana Centro
** Dipartimento di Scienze del farmaco – Università del Piemonte Orientale - Novara
BIBLIOGRAFIA
- Agenzia Italiana del Farmaco, AIFA. Farmaci utilizzabili per il trattamento della malattia COVID-19. Sito web: https://www.aifa.gov.it/aggiornamento-sui-farmaci-utilizzabili-per-il-trattamento-della-malattia-covid19
- Slow Pharmacy, Associazione Scientifica; sezione COVID-19. Sito web: https://www.ansa.it/canale_saluteebenessere/notizie/medicina/2020/10/16/coronavirus-oms-nessun-beneficio-dal-remdesivir_11ab67c0-86e9-46ff-b416-659147838bdf.html
- World Health Oganization. Sito web: https://www.who.int/news/item/15-10-2020-solidarity-therapeutics-trial-produces-conclusive-evidence-on-the-effectiveness-of-repurposed-drugs-for-covid-19-in-record-time
- Commissine europea. Sito web: https://ec.europa.eu/italy/news/20201008_la_commissione_ue_firma_contratto_aggiudicazione_congiunta_per_remdesivir_it
- European Medicines Agency, EMA. Veklury. Sito web: https://www.ema.europa.eu/en/medicines/human/EPAR/veklury
- Agenzia Italiana del Farmaco, AIFA. Registro Veklury. Sito web: https://www.aifa.gov.it/web/guest/-/attivazione-registro-veklury-remdesivir-
- ARS Toscana, Agenzia regionale di Sanità. Il punto sugli anticorpi monoclonali per il COVID-19. Sito web: https://www.ars.toscana.it/tutte-le-news/2-articoli/4306-nuovo-coronavirus-punto-vaccino-terapie-covid-19-sars-cov-2-trattamenti-sperimentazione-vaccini-cure.html#anticorpi-monoclonali
- ARS Toscana, Agenzia regionale di Sanità. Il punto sui vaccini per il COVID-19. Sito web: https://www.ars.toscana.it/2-articoli/4408-nuovo-coronavirus-vaccini-in-sperimentazione.html
- ANSA.it, sezione NEWS. Come funziona il vaccino della Pfizer-Biontech. Sito web: https://www.ansa.it/canale_scienza_tecnica/notizie/biotech/2020/11/10/come-funziona-il-vaccino-della-pfizer-biontech-_570d55c9-7159-441c-b82d-b791210b3678.html
- FIERCE Biotech; COVID-19 section. Sito web: https://www.fiercebiotech.com/biotech/pfizer-biontech-sees-stock-hope-soar-as-it-says-covid-19-vax-90-effective-plots-november?utm_source=fiercepharma&utm_medium=internal&utm_campaign=banner-promo&fbclid=IwAR08VBE-5fUramoIa3AUmjInznsfIwesHIblp22Eqb3H6qKGxmJCmq1Kfb0
- DOTTPROF.com. Sitoweb: https://dottprof.com/2020/11/vaccino-per-covid-19-una-buona-notizia/
