L’epidemia SARS-Cov-2 si è ormai diffusa in tutto il mondo e sta interessando oltre 20 milioni di persone che risultano positivi al virus, con, ad oggi,  circa 800 mila persone decedute. I mezzi di prevenzione (distanziamento, mascherina, lavaggio delle mani) sono certamente utili per limitarne la diffusione, ma sono condizionati dal senso di (ir)responsabilità delle persone e dal livello culturale e socio-economico delle popolazioni interessate. I risultati del trattamento terapeutico e farmacologico dei malati sono ancora estremamente variabili e critici e non accessibili per tutti i pazienti nel mondo. L'unica via d’uscita sembrerebbe essere lo sviluppo rapido di un vaccino per contrastare la diffusione della malattia e ridurne la letalità.
circa 800 mila persone decedute. I mezzi di prevenzione (distanziamento, mascherina, lavaggio delle mani) sono certamente utili per limitarne la diffusione, ma sono condizionati dal senso di (ir)responsabilità delle persone e dal livello culturale e socio-economico delle popolazioni interessate. I risultati del trattamento terapeutico e farmacologico dei malati sono ancora estremamente variabili e critici e non accessibili per tutti i pazienti nel mondo. L'unica via d’uscita sembrerebbe essere lo sviluppo rapido di un vaccino per contrastare la diffusione della malattia e ridurne la letalità.
Cos’è il virus SARS-CoV-2?
Questo virus fa parte dell’ampia famiglia dei coronavirus che provocano malattie che vanno dal comune raffreddore invernale a malattie molto più gravi come la Sindrome Respiratoria del Medio Oriente (MERS) e la Sindrome Respiratoria Acuta Grave (SARS). Questi tipi di virus si chiamano coronavirus
perché i loro virioni (la parte infettiva) appaiono al microscopio elettronico come piccoli globuli, sui quali ci sono tante piccole punte proteiche che ricordano quelle di una corona.
Una di queste “punte” conosciuta come Spike ha la funzione di ancorarsi alle cellule dell’organismo umano permettendo l’ingresso del virus. Una volta che il virus è entrato dentro la cellula umana, l’RNA virale viene immediatamente tradotto dalla cellula infetta in proteine virali. Successivamente, la cellula infetta muore liberando milioni di nuove particelle virali.
A questo punto, l’organismo ospite (uomo), attiva una risposta immunitaria. Il quadro clinico legato alla presenza del virus e alla sua replicazione e, probabilmente, anche alla reazione immunitaria che l’organismo umano sviluppa contro il virus, sono molto variabili. Si calcola che nel 70% dei pazienti la malattia sia asintomatica o con sintomi molto lievi (raffreddore, dolori muscolari, oculorinite), mentre nel restante 30% si ha una sindrome respiratoria con febbre elevata, tosse, fino a raggiungere l’insufficienza respiratoria grave che può richiedere il ricovero in terapia intensiva.
Su quali tipologie di vaccini si sta lavorando?
La Coalition for Epidemic Preparedness and Innovations (CEPI), organizzazione internazionale che ha lo scopo di promuovere lo sviluppo e lo stoccaggio di vaccini contro microorganismi in grado di causare nuove epidemie, sta coordinando i numerosi progetti per la preparazione di vaccini contro il virus SARS-CoV-2.
A causa della recente scoperta del virus e della difficoltà di prevedere il tipo di risposta immunitaria prodotta, le strategie adottate risultano molto diversificate fra loro e, di conseguenza, il tipo di vaccino in grado di proteggere dall’infezione.
In particolare, i ricercatori stanno lavorando su tre tipologie di vaccini:
- Vaccino a RNA: si tratta di una sequenza di RNA sintetizzata in laboratorio che, una volta iniettata nell’organismo umano, induce le cellule a produrre una proteina simile a quella verso cui si vuole indurre la risposta immunitaria (producendo anticorpi che, conseguentemente, saranno attivi contro il virus).
- Vaccino a DNA: il meccanismo è simile al vaccino a RNA. In questo caso viene introdotto un frammento di DNA sintetizzato in laboratorio in grado d’indurre le cellule a sintetizzare una proteina simile a quella verso cui si vuole indurre la risposta immunitaria.
- Vaccino proteico: utilizzando la sequenza RNA del virus (in laboratorio), si sintetizzano proteine o frammenti di proteine del capside virale. Queste, iniettate nell’organismo combinate con sostanze che esaltano la risposta immunitaria, inducono la risposta anticorpale da parte dell’individuo.
A che punto siamo con il vaccino contro il coronavirus?
La forte pressione esercitata dalla pandemia di COVID-19 e la speranza che la ricerca scientifica, porti alla rapida realizzazione di un vaccino efficace, sono in contrasto con le norme che invece prevedono una sequenza di studi rigorosi per valutarne efficacia e sicurezza per i quali sarebbero necessari tempi lunghi.
Nello sviluppo tradizionale, la ricerca ha inizio con la valutazione in vitro delle strutture dell’agente che va a costituire la componente attiva del vaccino. Una volta definito questo aspetto ha inizio la fase cosiddetta preclinica in cui viene testata la risposta immunitaria e/o i meccanismi avversi su organismi viventi complessi non umani. Superata questa fase comincia la vera e propria sperimentazione clinica sull’uomo che si realizza in più fasi (4) in base al modello sperimentale adottato, la quantità di componente somministrata e la numerosità del campione di popolazione coinvolta. Le prime tre fasi precedono la commercializzazione del vaccino, mentre la quarta fase viene effettuata quando il vaccino è già in commercio.
Lo sviluppo tradizionale del vaccino è quindi un processo lungo che normalmente richiede anni e con trial clinici che richiedono test su migliaia di persone. Se il vaccino risulta sicuro ed efficace, deve poi rispondere a tutti i requisiti regolatori e ottenere l'approvazione.
Nell'attuale emergenza, è stato invece proposto un periodo di tempo più ristretto compreso tra 12 e 18 mesi, con team di esperti di tutto il mondo che lavorano per aumentare la velocità per trovare un candidato efficace. Inoltre, trattandosi di un’emergenza sanitaria che interessa tutto il mondo, la capacità di produzione dovrebbe essere garantita prima del termine degli studi clinici e ripartita globalmente per garantirne anche un'equa distribuzione.
A tal proposito, l'OMS ha riunito leader mondiali e partner sanitari, compresi quelli del settore privato, in un'iniziativa mirata ad accelerare lo sviluppo e la produzione del nuovo vaccino anti Covid-19, di test e trattamenti per consentire un accesso equo in tutto il mondo.La realizzazione di un vaccino efficace e sicuro, oltre ad essere l’obiettivo primario della sanità pubblica in tutto il mondo, è anche, considerata la diffusione dell’epidemia e la necessità globale della vaccinazione, una competizione per le ricadute economiche e di prestigio tra numerose società multinazionali del settore farmaceutico. Lo dimostra il fatto che attualmente vengono testati oltre 170 possibili vaccini contro Sars-CoV-2, dei quali 27 sono in fase clinica e di questi, 8 hanno iniziato studi di fase III, che dovranno coinvolgere migliaia di partecipanti in tutto il mondo.
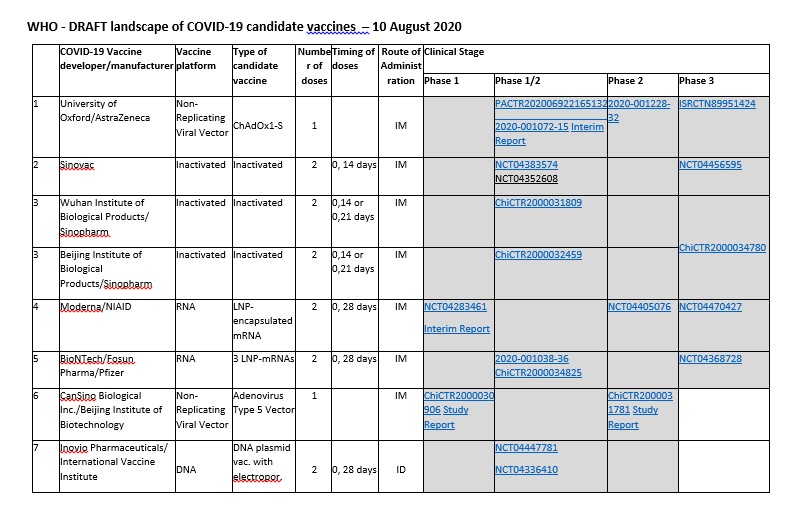
Vediamo nella tabella accessibile sul sito del WHO, quali sono i vaccini che hanno iniziato o si apprestano ad iniziare gli studi clinici di fase III.
- Vaccino ChAdOx1 nCoV-19 (UK-IT) Da The Lancet del 20 luglio 2020: Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. Si tratta di uno studio multicentrico randomizzato svolto in UK, finalizzato a determinare l'efficacia, la sicurezza e l'immunogenicità del vaccino ChAdOx1 nCoV-19, allestito presso la Clinical Biomanufacturing Facility dell'Università di Oxford, che utilizza un adenovirus come vettore per un trasporto delle sequenze genetiche necessarie alle cellule umane per la sintesi dell'antigene virale.Sono stati arruolati 1.077 adulti sani (età compresa 18-55 anni) assegnati in modo casuale (1:1) alla vaccinazione con ChAdOx1 nCoV-19 (n = 543) che esprime la proteina Spike SARS-CoV-2, rispetto a un vaccino meningococcico coniugato (MenACWY) come controllo (n=534). I risultati preliminari mostrano che il vaccino candidato ChAdOx1 nCoV-19 somministrato in una singola dose era sicuro e tollerato, nonostante un profilo di reattogenicità più elevato rispetto al vaccino di controllo (MenACWY). Non si sono verificate gravi reazioni avverse a ChAdOx1nCoV-19. In conclusione il vaccino ChAdOx1 nCoV-19 ha mostrato un profilo di sicurezza accettabile e un aumento delle risposte anticorpali dose-dipendente e dopo una seconda dose. Questi risultati, insieme all'induzione di risposte immunitarie sia umorali che cellulari, supportano la valutazione su larga scala di questo vaccino candidato in un programma di fase 3 in corso.
- Vaccino inattivato per SARS-CoV-2 (Cina). Il trial clinico “Safety and Immunogenicity Study of Inactivated Vaccine for Prophylaxis of SARS CoV-2 Infection (COVID-19)” è uno studio clinico randomizzato in fase I/II, in doppio cieco e controllato con placebo del vaccino inattivato per SARS-CoV-2 prodotto da Sinovac Research & Development Co. Lo scopo di questo studio è quello di valutare la sicurezza e l'immunogenicità del vaccino sperimentale in adulti sani di età compresa tra 18 e 59 anni. Sono previsti 744 soggetti da arruolare, di cui 144 nella fase I e 600 nella fase II. Ciascun partecipante riceverà due dosi di vaccino sperimentale o placebo al tempo 0 e al 14° giorno oppure al tempo 0 e al 28° giorno.
- Vaccino inattivato SARS CoV.2 (Cina). Prodotto da: Wuhan Institute of Biological Products/ Sinopharm. A Phase III clinical trial for inactivated novel coronavirus pneumonia (COVID-19) vaccine (Vero cells). Randomized, Double Blind, Parallel Placebo Controlled, Phase III Clinical Trial to Evaluate the Safety and Protective Efficacy of Inactivated SARS-CoV-2 Vaccine in Healthy Population Aged 18 Years and above. Lo studio unificato ha l’obiettivo di valutare la protezione e l’efficacia del vaccino inattivato SARS-CoV-2 (Vero Cell) dopo l’immunizzazione nella prevenzione di malattie causate da SARS-CoV-2 in soggetti sani maggiori di 18 anni.
- Vaccino mRNA-1273 (USA). Sponsorizzato dal National Institute of Allergy and Infectious Diseases (NIAID) e condotto da Moderna, lo studio clinico in aperto, a dose variabile, è attualmente in fase I (data di avvio 3 marzo 2010), che prevedeva l’arruolamento di 45 persone in buona salute, di entrambi i generi con età compresa fra i 18 ed i 55 anni. Lo studio Safety and Immunogenicity Study of 2019-nCoV Vaccine (mRNA-1273) for Prophylaxis SARS CoV-2 Infection (COVID-19) è progettato per valutare la sicurezza, la reattogenicità (cioè la capacità di indurre effetti collaterali e reazioni indesiderate) e la immunogenicità (indurre risposta immunitaria) di un nuovo vaccino mRNA-1273 a base di mRNA incapsulato con nanoparticelle lipidiche (LNP) in grado di codificare la proteina Spike del SARS-CoV-2 con conseguente stimolazione della risposta immunitaria da parte dell’uomo. Il trial prevede la suddivisione dei partecipanti in tre bracci paralleli in base ai microgrammi di mRNA-1273 somministrati (25 microgrammi [mcg], 100 mcg, 250 mcg) attraverso un’iniezione intramuscolare al giorno 1 e al giorno 29. I soggetti saranno seguiti in follow-up per un periodo di 12 mesi dopo la seconda somministrazione.
- Vaccino BNT162 (USA). Il 30 aprile 2020, è iniziata la fase I/II del trial: “Study to Describe the Safety, Tolerability, Immunogenicity, and Potential Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Adults”, randomizzato, controllato con placebo, con valutazione in cieco.Lo studio sul vaccino BNT162 anti Covid-19 sviluppato da BioNTech (Germania) e Pfizer (USA) valuterà la sicurezza, la tollerabilità, l'immunogenicità e la potenziale efficacia di un massimo di 4 diversi vaccini RNA SARS-CoV-2 candidati contro COVID-19.Due dei 4 vaccini candidati (BNT162) includono un mRNA modificato, uno include un mRNA contenente uridina e il quarto candidato al vaccino utilizza mRNA auto-amplificante. Ognuno di questi mRNA è combinato con una formulazione di nanoparticelle lipidiche (LNP). La sequenza “spike” è inclusa in due dei vaccini candidati, mentre negli altri due è incluso il dominio vincolante del recettore della proteina del coronavirus “spike”.Lo studio valuterà sia la singola dose che la doppia dose e fino a 3 livelli differenti di dosi diverse in tre gruppi d’età differenti (dai 18 ai 55 anni, dai 65 agli 85 anni e dai 18 agli 85 anni). Lo studio consiste di 3 fasi: 1) identificare i vaccini, i livelli di dose, il numero di dosi e il programma di somministrazione; 2) espansione della coorte; 3) vaccino candidato e dose individuata in larga scala.
- Vaccino ricombinante contro il coronavirus (Ad5-nCoV) (Cina). Da The Lancet del 20 luglio 2020: Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebocontrolled, phase 2 trial. Sono stati pubblicati i risultati del primo trial per valutare la sicurezza, la reattogenicità e l'immunogenicità del vaccino ricombinante contro il coronavirus (Ad5-nCoV) che utilizza un adenovirus (di tipo 5, non replicante) per trasportare il materiale genetico che codifica per la proteina Spike di SARS-CoV-2. Lo studio è registrato su ClinicalTrials.gov: NCT04341389. Il vaccino è prodotto da Beijing Institute of Biotechnology (Cina) e CanSino Biologics Inc. (Cina). Lo studio randomizzato, in doppio cieco, controllato con placebo, di fase 2 è stato svolto in un unico centro a Wuhan (Cina), con il coinvolgimento di 603 volontari. Il vaccino ha indotto la sieroconversione di anticorpi neutralizzanti nel 59% e nel 47% dei partecipanti (1 × 10¹¹ e 5 × 10¹⁰ particelle virali) e sieroconversione dell'anticorpo contro il dominio (RBD) che può legarsi specificamente al recettore ACE2 sulle cellule bersaglio nel 96% e 97% (1 × 10¹¹ e 5 × 10¹⁰). Le risposte specifiche T-cellulari misurate con IFNγ-ELISpot sono state riscontrate nel 90% dei soggetti che hanno ricevuto una dose di particelle virali 1 × 10¹¹ e nell'88% di quelli che hanno ricevuto una dose di 5×10¹⁰. Inoltre, il 95% dei partecipanti del gruppo che aveva ricevuto una dose 1×10¹¹ e il 91% dei soggetti del gruppo con dose 5 × 10¹⁰ ha mostrato immunità cellulare o umorale al 28° giorno dopo la vaccinazione. In conclusione, i risultati di questo studio hanno ampliato le conoscenze sull'immunogenicità e sulla sicurezza del vaccino vettoriale Ad5-nCoV, supportando l’avvio di uno studio di efficacia di fase III.
- Vaccino INO-4800 (USA). Il terzo trial clinico non randomizzato, attualmente in fase I, sponsorizzato dalla INOVIO Pharmaceuticals e condotto in collaborazione con la Coalition for Epidemic Preparedness Innovations (CEPI). Il trial Safety, Tolerability and Immunogenicity of INO-4800 for COVID-19 in Healthy Volunteers è progettato per la valutare il grado di sicurezza, tollerabilità e profilo immunologico del vaccino INO-4800 somministrato mediante iniezione intradermica seguita da elettroporazione (EP) (tecnica utilizzata per facilitare il passaggio di farmaci nella membrana cellulare) attraverso l’utilizzo di uno specifico disposititivo CELLECTRA® 2000.In questa fase i soggetti coinvolti sono 40, di età compresa fra i 18 ed i 50 anni, in buona salute e di entrambe i generi, sono suddivisi in 2 gruppi; un gruppo con somministrazione di 1 milligrammo di vaccino INO-4800 per via intradermica al tempo 0 e al 28 giorno (4 settimane) seguite da EP; un gruppo con somministrazione di 2 milligrammi di vaccino INO-4800 al tempo 0 e al 28° giorno (4 settimane).
A questi va aggiunto il vaccino russo, annunciato con clamore in modo inusuale da Putin e registrato quando ancora gli studi di fase III sono appena iniziati (3 agosto). La comunità scientifica internazionale è perplessa su questa registrazione del vaccino, prima della fine della sperimentazione. Inoltre al momento, Mosca non ha reso disponibile le evidenze scientifiche sul farmaco (non ci sono pubblicazioni), dunque gli esperti non sono in grado di confermarne né la sicurezza né l’efficacia dichiarata.
Si tratterebbe di un vaccino a base di un vettore virale (adenovirus 5) modificato per esprimere la proteina spike, simile a quello sperimentato dalla cinese CanSino.
A realizzarlo è stato il Gamaleya National Research Centre for Epidemiology and Microbiology. Il trial clinico sarebbe partito ad aprile, la fase 2 si è conclusa il 2 agosto e il 3 agosto è iniziata la fase 3, bruciando tutte le tappe. L’Associazione delle organizzazioni di ricerca clinica, che riunisce le aziende farmacologiche russe e le strutture di ricerca ha espresso riserve sul vaccino russo, segnalando che non era stato sufficientemente testato e aveva chiesto al ministero della Salute russo di rinviare la registrazione di questo vaccino, per la mancanza di test adeguati. Richiesta caduta nel vuoto proprio come quella avanzata dall’organizzazione Mondiale della Sanità che ha invocato il rispetto dei protocolli e dei regolamenti in vigore per lo sviluppo di un vaccino anti-Covid-19. La stessa Oms ha commentato invitando alla cautela: “Qualsiasi vaccino, o farmaco, dovrebbe, ovviamente, passare attraverso tutti i test e i trial clinici prima di essere approvato per la commercializzazione”. E’ evidente il tentativo di uno stato di precostituirsi un vantaggio economico e di immagine rendendo disponibile un vaccino sperimentato solo su una settantina di volontari, mettendo però a rischio l’incolumità delle persone.
Ma anche per i vaccini sopra evidenziati, che invece hanno seguito i protocolli concordati per la sperimentazione clinica, in generale, questi primi risultati vanno interpretati con cautela e non possono essere utilizzati per un confronto tra i diversi vaccini candidati, perché non sappiamo quale siano le risposte immunitarie più efficaci nella prevenzione dell’infezione.
Nell’editoriale di Science del 31 luglio, H.Thorp, ha messo in evidenza le diverse incognite scientifiche che permangono nonostante i progressi condotti dalle diverse industrie farmaceutiche. “Il vaccino resta la migliore via d’uscita dalla crisi pandemica”, sottolinea. Occorre però conservare “un cauto ottimismo” rispetto ai risultati ottenuti. Prima di tutto non possiamo sapere se il vaccino sia sicuro ed efficace nei lunghi tempi, e un anno di sperimentazione non basta per offrire delle risposte certe. Gli studi condotti finora inoltre suggeriscono che potrebbero essere necessarie due dosi; il che comporterebbe una sfida logistica ulteriore rispetto a quella già esistente nella prospettiva di produrre e distribuire una quantità sufficiente di vaccino.
BIBLIOGRAFIA
Network Bibliotecario Sanitario Toscano – Indirizzo web: http://www.nbst.it/654-vaccino-coronavirus-quali-terapie-farmaci-covid-19-cure.html
Quotidiano sanità – Indirizzo web: http://www.quotidianosanita.it/scienza-e-farmaci/articolo.php?articolo_id=87522
The Lancet - https://www.thelancet.com/journals/lancet/article/PIIS0140-6736%2820%2931604-4/fulltext
Clinical Trials.com - https://clinicaltrials.gov/ct2/show/NCT04352608?term=NCT04352608&draw=2&rank=1
Clinical Trials.com - https://clinicaltrials.gov/ct2/show/NCT04283461?term=mrna-1273&draw=2
Clinical Trials.com - https://clinicaltrials.gov/ct2/show/NCT04368728
The Lancet -https://www.thelancet.com/journals/lancet/article/PIIS0140-6736%2820%2931605-6/fulltext#seccestitle10
Clinical Trials.com https://clinicaltrials.gov/ct2/show/study/NCT04336410?term=inovio&cond=covid-19&draw=2#contacts
WHO - https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines
Science - https://science.sciencemag.org/content/369/6503/483