Premessa
Le leggi e le norme che hanno incluso la nozione di innovatività dei farmaci
La legge 648 del 1996 La prima norma di legge che ha citato i medicinali innovativi ha quasi 30 anni: la legge 648/96. All’articolo 1 recitava:
La prima norma di legge che ha citato i medicinali innovativi ha quasi 30 anni: la legge 648/96. All’articolo 1 recitava:
“Art. 1. comma 4 –
“Qualora non esista valida alternativa terapeutica, sono erogabili a totale carico del Servizio sanitario
nazionale, a partire dal 1 gennaio 1997, i medicinali innovativi la cui commercializzazione è autorizzata in altri Stati ma non sul territorio nazionale, i medicinali non ancora autorizzati ma sottoposti a sperimentazione clinica e i medicinali da impiegare per un'indicazione terapeutica diversa da quella autorizzata, inseriti in
apposito elenco predisposto e periodicamente aggiornato dalla Commissione unica del farmaco conformemente alle procedure ed ai criteri adottati dalla stessa. L'onere derivante dal presente comma, quantificato in lire 30 miliardi per anno, resta a carico del Servizio sanitario nazionale nell'ambito del tetto di spesa programmato per l'assistenza farmaceutica”.
L’algoritmo Montanaro del 2007
Solo nel 2007 con una specifica Determina l’AIFA introduce il percorso valutativo dell’innovazione farmaceutica sulla base di un algoritmo “Montanaro” dal nome del farmacologo bolognese che insieme a N. Martini et al lo rese disponibile e noto agli addetti e al pubblico1.
La rilevanza di questo approccio deriva dalla individuazione di tre criteri principali e della loro graduazione:
- la gravità della patologia (grave, fattore di rischio per malattia grave, non grave);
- l’esistenza di trattamenti precedenti (assenti, non presenti per tutti i pazienti, presenti);
- l’entità del beneficio (importante, moderato, modesto). Inoltre, ci poteva essere anche una valutazione del grado di innovazione tecnologica che consentiva di recuperare l’innovatività con un percorso secondario.
L’innovazione che scaturiva dalla valutazione dei fattori considerati era graduato quale in livelli:
- importante,
- moderata o
- modesta (quest’ultima talora solo potenziale).
Le critiche principali a questa prima identificazione di domini e loro graduazione consistevano nell’eccesso di discrezionalità della valutazione e nella mancanza di confronto con le società richiedenti la valutazione. Il passaggio successivo è consistito nell’ Accordo interregionale tra le regioni in tema di accesso ai farmaci innovativi2, che in parte poneva rimedio alla prassi consolidata in AIFA dell’impiego di un algoritmo criticato con un accordo ma ancora non sostenuto da una base legislativa con l’adozione di criteri determinati e incontrovertibili.
Il Decreto Balduzzi del 2012
A tale situazione pose rimedio il ministro Balduzzi che con l’adozione del Parlamento del suo decreto D.L. 158/2012 che all’articolo 10, commi da 2 a 6 ha previsto che, in applicazione dei LEA, le Regioni fossero tenute erogare e utilizzare uniformemente i medicinali innovativi di particolare rilevanza3 .
A fronte di prodotti dotati di valore aggiunto terapeutico, il legislatore intendeva così garantire una parità di trattamento per tutti gli assistiti nei vari ambiti regionali, indipendentemente dalla presenza dei prontuari regionali, a loro volta sottoposti a monitoraggio da parte dell’AIFA, salva la possibilità per ciascuna Regione di sollecitare all’AIFA una revisione del suo precedente giudizio, in caso di dubbi sulla reale innovatività.
Legge di Bilancio 2017
Questi elementi di criticità sollevabili dalle Regioni avverso la valutazione discrezionale di AIFA e la farraginosità dell’algoritmo informatizzato proposto portarono inevitabilmente ad una rivisitazione della normativa culminata 5 anni dopo con la adozione della legge 232/2016 (Legge di Bilancio 2017), che all’art.1 comma 401 delegava AIFA a stabilire entro il 31 marzo 2017, con determinazione del direttore generale e previo parere della Commissione consultiva tecnico-scientifica, i criteri generali per la classificazione dei farmaci innovativi e a innovatività condizionata, nonché quelli peculiari ai medicinali oncologici.
Si trattava di un passo in avanti importante perché si assegnava ad AIFA, in accordo con le Regioni che venivano a disporre di ben due Fondi di 500 milioni di euro ciascuno per gli innovativi e per gli innovativi oncologici, la valutazione della innovatività sulla base di 3 domini bene definiti e graduati.
Le organizzazioni di categoria industriale prendevano atto con soddisfazione che la spesa per gli innovativi non rientrava nei tetti stabiliti e finanziati dal SSN per tutti gli altri farmaci, determinando la non partecipazione ai criteri del payback cioè all’obbligo di ripiano in caso di sfondamento dei tetti di spesa. Solo nel caso di superamento della spesa prevista per i fondi avrebbe determinato tale ricorso ma suddiviso tra tutte le imprese.
Il punto di equilibrio tra interessi era raggiunto.
Da allora vi sono stati pochi ritocchi più che altro in relazione alle conferme della innovativa nel tempo prefissato di 36 mesi.
Ma la sostanza della legge era determinata nella fissazione dei tre domini attuali:
- il bisogno terapeutico;
- il valore terapeutico aggiunto;
- la qualità delle prove ovvero la robustezza degli studi clinici, da ponderare alla luce del metodo GRADE - Grading of Recommendations Assessment, Development and Evaluation4 e della graduazione conseguente applicata dalla CTS prima e dalla CSE dopo, in ordine decrescente:
- Massimo,
- Importante,
- Moderato,
- Scarso,
- Assente,
alla luce della qualità delle prove che, a sua volta, può essere:
- Alta,
- Moderata,
- Bassa o
- Molto Bassa.
Il riconoscimento dell’innovatività può avvenire quindi a vantaggio dei farmaci che soddisfino un bisogno terapeutico e siano dotati di un valore terapeutico aggiunto di livello massimo o almeno Importante, sostenuti da una qualità delle prove Alta, con conseguente esclusione dei prodotti che siano classificati ai livelli più bassi per tutti i parametri, e possibilità di valutazione caso per caso per le situazioni intermedie, in ragione del peso relativo dei singoli elementi considerati.
Vanno anche considerate le conseguenze della adozione del riconoscimento della innovatività:
- la piena innovatività dà luogo all’accesso del medicinale ai fondi per l’innovazione e all’inserimento diretto nei Prontuari Terapeutici Regionali;
- l’innovatività condizionata (o potenziale), che comporta l’inclusione del prodotto nei Prontuari Terapeutici Regionali, ma anche la rivalutazione obbligatoria a 18 (diciotto) mesi dalla sua concessione e possibilità che in tale occasione possa essere attestata la piena innovatività, che consente al prodotto di fruire dei fondi per il tempo residuo prima della scadenza del termine dei 36 (trentasei) mesi.
In caso di non riconoscimento della innovatività non si ha diritto a questi due benefici (inclusione nel PTR/PTA e assegnazione di fondo).
La domanda che ci si deve porre è perché a distanza di 8 anni viene richiesta una rivisitazione con modifiche
sostanziali dei domini di valutazione adottati da AIFA.
Il tema dei roadblock costituito dalla attivazione della valutazione di inserimento dei prodotti nei PTR non appare così probante perché alcune Regioni strategiche hanno da tempo abolito il PTR e/o le CTR come Piemonte, Lombardia, Veneto, Friuli- Venezia Giulia, Liguria, Toscana, Lazio, Sicilia.
È più probabile che ci possa essere un ulteriore fattore di natura economica che possa essere meglio valutabile.
La dimensione del Fondo della innovatività
In ordine i fondi per l’innovatività dei medicinali erano stati di 500 milioni ciascuno pari complessivamente a 1 miliardo di euro. Non era stata prevista alcuna regola di intercomunicabilità tra i due fondi.
L’obiettivo di modificare le regole per l’ottenimento dell’utilizzo pieno dei due fondi venne successivamente raggiunto grazie anche qui ad un emendamento che ha reso possibile nel 2021 l’unificazione dei due fondi in uno solo ( 5 ). Il passaggio successivo era quello dell’incremento del fondo a disposizione delle regioni che venne raggiunto con un ulteriore emendamento inserito nella l. 234/2021 ( 6 ): l’incremento prevede ulteriori 600 (seicento) milioni nel periodo tra il 2022 e il 2024. Ad oggi il fondo è di 1,3 miliardi di euro.
La governance del settore farmaceutico
Quali sono le “vere” motivazioni che hanno portato a prospettare emendamenti ai criteri intervenuti con l’art.1
commi 281-292 della legge n.207/2024 (Legge di Bilancio 2025)?
Prima di entrare nel merito delle questioni relative alle modifiche dei criteri per il riconoscimento della innovatività
occorre vederle inserite nel più ampio quadro della “governance” del settore.
La proposta per la definizione dei nuovi criteri per la valutazione della innovatività costituisce uno degli esempi più recenti della capacità di penetrazione e di successo dell’attività di natura lobbistico-farmaceutica che nello specifico settore si è realizzata accanto ad altre con obiettivi più consistenti come ad esempio:
- l’abolizione o la riduzione dell’impatto del payback farmaceutico (riduzione di 1,050 miliardi per il settore DM)
- la rivisitazione del sistema di remunerazione dell’attività della distribuzione intermedia e finale del farmaco (incremento da determinare a un anno dalla introduzione)
- la riduzione dell’impatto della distribuzione pubblica dei farmaci quale diretta e per conto e il trasferimento nel canale convenzionale con il conseguente incremento del valore tetto per evitare il rischio payback (rideterminazione della percentuale dei margini dei distributori intermedi a danno di quello dell’industria)
L’obiettivo di revisione dei criteri di innovatività si realizza mediante la loro nuova definizione che si basa nella
proposizione normativa e successivo recepimento nella legge veicolo prescelta (legge di Bilancio 2025) da parte della maggioranza degli aventi titolo al voto.
Il caso
La legge ha però previsto in termini di salvaguardia che fosse l’Agenzia a determinare i criteri definitivi, Per questo, fortunatamente, è stata aperta una consultazione pubblica con chiusura il 25 marzo scorso, nella prospettiva di contribuzione di pareri e suggerimenti per la verifica e auspicabile rivisitazione; in assenza della quale, gli effetti che potrebbero determinarsi sono sintetizzabili nella massima: “tutti innovativi, nessuno innovativo”.
Sembra siano pervenute un centinaio di note di suggerimenti o approfondimenti di singoli e associazioni che lasciano ben sperare per la ridefinizione dei criteri così come si stava configurando la situazione, confidando in uno spirito più critico rispetto ai tre criteri di recepimento nella visione parlamentare.
I rischi presenti nel recepimento acritico della configurazione attuale sono inerenti ai 4 punti principali in cui la
proposta si articola:
| Estensione dell’accesso al Fondo per i farmaci innovativi anche ai medicinali valutati con innovatività condizionata, oltre a quelli con innovatività piena, ampliando così le possibilità di accesso alle terapie più avanzate. | Assenza di una graduazione degli effetti inseritivi ed economici conseguenti |
| Bipartizione del fondo con 900 milioni per i farmaci che ricevono un giudizio di innovatività piena e 300 milioni per i farmaci che ricevono un giudizio di innovatività condizionata. |
Assenza di regole sulla intercomunicabilità |
| Introduzione di una nuova partizione con 100 milioni destinata a antibiotici classificati come “reserve” dall’Organizzazione Mondiale della Sanità (OMS) o cosiddetti “listed”, e cioè attivi nei confronti di almeno un patogeno considerato prioritario dall’elenco “Bacterial Priority Pathogens List” dell’OMS. | Assenza di valutazione della innovatività di prodotto nella nuova classe “OMS reserve o listed” Configurazione come finanziamento privilegiato |
| Ampliamento dei criteri considerati nella valutazione dell’innovatività di un farmaco, affermando da un lato che essa dipende dai risultati di efficacia e sicurezza rispetto alle alternative terapeutiche disponibili, e dall’altro che tale valutazione viene effettuata " …sulla base della tecnologia di produzione del suo principio attivo, del suo meccanismo d’azione, della modalità della sua somministrazione al paziente..." | Elevazione al rango di criteri di valutazione di parametri di rilievo (cfr. qualità della vita) o di mero supporto di riferimento (cfr. tecnologia di produzione, organizzazione dell’assistenza sanitaria) |
Come provare a recepire in maniera “intelligente”
Nel contesto farmaceutico e sanitario, l’innovazione può essere utilmente stratificata in due distinti settori:
- l’innovazione dirompente
- l’innovazione incrementale.
Il SSN deve valutare la diversa tipologia di appartenenza dell’innovazione prima di effettuare una specifica
assegnazione della innovatività ed i benefici ad essa attribuibili come previsto dalla normativa vigente.
L’innovazione dirompente
Per innovazione dirompente (in inglese disruptive innovation) si intende un'innovazione che cambia radicalmente il modo in cui si affronta un problema, spesso sostituendo soluzioni esistenti con approcci completamente nuovi, più semplici, accessibili o efficaci. Il concetto è stato introdotto da Clayton Christensen negli anni 907 e si applica a molti ambiti, inclusa la sanità.
Nel contesto farmaceutico e sanitario, l’innovazione dirompente può significare:
- un nuovo farmaco che supera o sostituisce completamente le terapie esistenti
- un trattamento che rende obsoleti strumenti o percorsi terapeutici consolidati
- una tecnologia diagnostica o terapeutica che consente una gestione completamente diversa della malattia,
ad esempio passando da cure ospedaliere a domiciliari - soluzioni che ridimensionano i costi pur mantenendo o migliorando l’efficacia clinica.
Sono presenti diversi esempi sia in ambito farmacologico e terapeutico che in quelle relativo ai dispositivi medici.
- Terapie CAR-T (es. Kymriah, Yescarta)
Obiettivi: Tumori ematologici come leucemia linfoblastica acuta e linfoma diffuso a grandi cellule B.
Motivazioni “rivoluzionarie”: È una terapia personalizzata: le cellule T del paziente vengono modificate geneticamente.
Sostituisce cicli di chemioterapia o trapianto con una singola infusione.
In Italia, è stata introdotta in centri di riferimento accreditati, richiedendo una riorganizzazione dei percorsi assistenziali. - Antivirali ad azione diretta per l’Epatite C (es. sofosbuvir)
Obiettivi: Infezione da HCV.
Motivazioni “rivoluzionarie”: Ha eliminato la necessità di trattamenti lunghi e poco tollerabili come l’interferone.
Garantisce la guarigione clinica completa in più del 95% dei casi.
Ha cambiato la strategia sanitaria nazionale, tanto che l’Italia ha lanciato piani di screening attivi. - Nuovi antibiotici “Reserve” (es. cefiderocol)
Obiettivi: Infezioni gravi da batteri resistenti.
Motivazioni “rivoluzionarie”: È tra i pochi antibiotici efficaci contro batteri “priority pathogens” secondo l’OMS.
La loro introduzione è accompagnata da strategie di stewardship antimicrobica e da fondo dedicato (DL 34/2023).
Rappresentano un cambio di approccio alla resistenza antimicrobica. - Reblozyl (luspatercept)
Obiettivi: Anemia da beta-talassemia e sindromi mielodisplastiche.
Motivazioni “rivoluzionarie”: Riduce significativamente la necessità di trasfusioni, migliorando la qualità di vita. Ha introdotto un meccanismo d’azione innovativo (modulatore della maturazione eritroide).
Impatta sull’organizzazione dei centri trasfusionali e sui costi indiretti (meno ospedalizzazioni, meno complicanze da sovraccarico di ferro). - Dispositivi digitali per la gestione del diabete (es. FreeStyle Libre)
Obiettivi: Monitoraggio glicemico.
Motivazioni “rivoluzionarie”: Ha sostituito la puntura del dito con un sistema di monitoraggio continuo. Permette telemedicina, condivisione in tempo reale dei dati con il medico. Cambia la gestione della cronicità e può prevenire complicanze gravi.
Innovazione incrementale
L’innovazione incrementale si riferisce a miglioramenti graduali o ottimizzazioni apportate a prodotti, processi o terapie già esistenti, senza modificarne radicalmente il funzionamento o il meccanismo d’azione. È l’opposto dell’innovazione dirompente, che cambia completamente lo scenario terapeutico o organizzativo.
Caratteristiche principali dell’innovazione incrementale:
- Migliora l’efficacia o la sicurezza di un farmaco già esistente.
- Introduce nuove formulazioni o vie di somministrazione (es. orale invece che endovenosa).
- Aumenta l’aderenza terapeutica (es. minor numero di somministrazioni).
- Non cambia la molecola di base, ma ne migliora l’uso.
Esempi di innovazione incrementale in ambito farmaceutico:
1. Nuove formulazioni a rilascio prolungato
- Es. morfina a rilascio prolungato per il dolore cronico.
- Vantaggio: meno somministrazioni → maggiore aderenza.
2. Associazioni fisse di farmaci
- Es. antipertensivi combinati in una singola compressa (ACE-inibitore + diuretico).
- Vantaggio: semplifica lo schema terapeutico.
3. Vie di somministrazione alternative
- Es. sumatriptan in spray nasale per l’emicrania (invece che iniettiva).
- Vantaggio: migliora l’accessibilità al trattamento.
4. Formulazioni pediatriche o geriatriche
- Es. farmaci liquidi o orodispersibili.
- Vantaggio: migliora l’aderenza nei pazienti fragili.
5. Ottimizzazione della produzione o della conservazione
- Es. vaccini che non necessitano della catena del freddo.
Le due tipologie a confronto
L’innovazione dirompente è considerata in relazione a:
- Impatto clinico significativo: porta cambiamenti radicali nella prognosi o nella qualità della vita dei pazienti(es. terapie geniche, CAR-T, antivirali per l’HCV).
- Alto valore terapeutico aggiunto rispetto alle alternative disponibili.
- Soddisfa bisogni terapeutici insoddisfatti in modo sostanziale.
L’innovazione incrementale viene invece messa in relazione a:
- Affinamento dei trattamenti esistenti: nuovi dosaggi, vie di somministrazione più semplici, minori effetti collaterali.
- Impatto sul piano dell’organizzazione, dell’aderenza terapeutica, cioè più graduale: è comunque importante, soprattutto per la cronicità e l’aderenza terapeutica, ma tende a ricevere innovatività condizionata o nessun riconoscimento formale.
Nella tabella 1 si riportano alcuni esempi.
Tabella 1 – Le differenze tra le tipologie
| Caratteristica | Innovazione Incrementale | Innovazione Dirompente |
| Definizione | Miglioramento graduale di un farmaco o terapia già esistente | Introduzione di una soluzione radicalmente nuova che cambia lo scenario terapeutico |
| Obiettivo |
Ottimizzare efficacia, sicurezza, aderenza o accessibilità |
Risolvere bisogni clinici non soddisfatti in modo completamente nuovo |
| Esempio | Nuova formulazione orale, rilascio prolungato, combinazioni fisse | Terapie geniche, CAR-T, CRISPR, farmaci first-in-class per malattie rare |
| Tipo di molecola |
Esistente (stessa Active Pharmaceutical Ingredient, API) |
Nuova (first-in-class o terapia completamente nuova) |
| Beneficio terapeutico |
Modesto o moderato, spesso legato alla Elevato, potenzialmente rivoluzionario atteso praticità d’uso |
Elevato, potenzialmente rivoluzionario |
| Caratteristica |
Innovazione Incrementale |
Innovazione Dirompente |
| Esempi specifici |
Insulina inalatoria, statine in |
CAR-T contro leucemie, terapia genica per SMA, antivirali contro HCV |
| Accesso al fondo farmaci innovativi |
Possibile, ma meno probabile senza beneficio clinico rilevante |
Più probabile se dimostra efficacia e impatto significativo |
| Rischio e costo di sviluppo |
Relativamente contenuti |
Elevati (ricerca, sviluppo e produzione complessi) |
La valutazione di AIFA dei prodotti a innovatività disruptiva
L'innovatività disruptiva si manifesta come una vera e propria rivoluzione nelle terapie esistenti e rappresenta una delle sfide più significative nella valutazione dei farmaci da parte di AIFA.
- Questi farmaci, che possono introdurre in terapia anche tramite meccanismi di azione completamente nuovi,
trattamenti che trasformano radicalmente la gestione di malattie complesse, possono avere un impatto profondo sulla salute dei pazienti e sulle modalità di cura. - Tuttavia, sebbene l'innovazione disruptiva sia spesso accompagnata da progressi terapeutici straordinari, la valutazione economica di tali farmaci presenta sfide particolari.
- AIFA, nel valutare un farmaco con innovatività disruptiva, deve considerare non solo l'efficacia e la sicurezza
del trattamento, ma anche l'effetto che potrebbe avere sul Sistema Sanitario Nazionale (SSN), sia in termini di costi diretti che di potenziale riduzione dei costi a lungo termine. Sebbene i farmaci disruptivi tendano ad avere prezzi elevati, la loro capacità di rivoluzionare la gestione delle malattie potrebbe portare a risparmi significativi in altre aree, come il trattamento di complicazioni gravi o l'ospedalizzazione. Un esempio classico di innovazione disruptiva è rappresentato dalle terapie geniche, che promettono di curare malattie genetiche rare e gravi in un'unica somministrazione. - In un'ottica di sostenibilità, AIFA deve bilanciare il valore terapeutico e i costi a breve termine, tenendo conto
anche degli impatti a lungo termine sulla salute pubblica e sull'economia del sistema sanitario. - L'adozione di una visione lungimirante nella valutazione dei farmaci disruptivi è essenziale per garantire che
l'innovazione possa essere integrata nel SSN in modo sostenibile, senza compromettere l'accesso ad altri
trattamenti essenziali.
La valutazione di AIFA dei prodotti a innovatività incrementale
- La valutazione dei farmaci da parte di AIFA dovrebbe tenere in considerazione anche i prodotti a innovatività
incrementale, ma in maniera residuale in quanto, pur non rappresentando una rivoluzione terapeutica, possono apportare possibili miglioramenti nella gestione delle malattie. - I farmaci con innovatività incrementale possono essere in grado di ottimizzare le modalità di somministrazione, ridurre gli effetti collaterali, migliorare l'aderenza al trattamento e, in generale, migliorare la qualità della vita del paziente. Questi miglioramenti sono sicuramente meno spettacolari rispetto a quelli di una vera e propria innovazione dirompente, e possono contribuire a una gestione più efficiente delle risorse sanitarie e ad un impatto positivo sugli esiti clinici.
- In un contesto di sostenibilità economica del Sistema Sanitario Nazionale (SSN), va considerato il potenziale
vantaggio che un farmaco incrementale può offrire a condizione che non siano rilevanti i costi che i farmaci incrementali possono indurre, riducendo il ricorso a trattamenti ospedalieri più complessi, diminuendo la necessità di ricoveri e migliorando l'efficienza complessiva del sistema. - Pertanto, la loro valutazione di AIFA non dovrebbe essere limitata solo all'innovatività "disruptive", ma dovrebbe includere anche un'analisi dei benefici “pratici” che questi prodotti possono apportare nel lungo periodo.
- AIFA deve mantenere un equilibrio nella valutazione economica, considerando che l’innovazione incrementale non sempre giustifica costi più elevati rispetto a trattamenti già esistenti. La valutazione deve quindi basarsi su una stima accurata dei benefici in relazione ai costi, garantendo un giusto compromesso tra innovazione e sostenibilità finanziaria.
I correttivi alla legge di bilancio 2025
La legge di bilancio ha introdotto dei correttivi alla precedente legge del 2017 puntano soprattutto a garantire il riconoscimento della innovatività non solo ai farmaci della tipologia disruptive ma anche a quella di tipo incrementale.
La modalità scelta è quella di intervenire sui domini “storici” implementandoli con l’elevazione a tale rango di parametri di:
- rilievo come la qualità della vita o di
- mero supporto di riferimento come la tecnologia di produzione o l’organizzazione dell’assistenza sanitaria.
Questa operazione si scontra però con una realtà valutativa ben bilanciata e sperimentata da centinaia di valutazioni pregresse con esiti premianti una innovatività “vera” per una buona maggioranza di prodotti disruptive vs quelli incrementali.
Per provare ad intervenire sulla legge tenendo conto che sarà per legge la stessa AIFA a declinare i criteri anche tenendo conto degli esiti della consultazione pubblica è però già possibili indicare i correttivi necessari per preservare gli obiettivi di valutazione avanzata dei prodotti “realmente” innovativi e finalizzare al meglio le risorse dedicate coi Fondi ed il superamento del roadblock più rilevante: i PTR/PTA.
| Modificazioni | Correttivo | Motivazione |
| Comparatore |
includere i prodotti presenti nell’elenco speciale della l.648/96 |
I prodotti ivi inclusi sono rimborsati dalle regioni anche se non formalmente approvati da AIFA |
| Comparatore |
Includere i prodotti galenici estemporanei a base dello stesso principio attivo |
La valutazione economica di riferimento costituisce la base di calcolo per la dimensione del potenziale premio di prezzo |
| Epidemiologia | Definizione della rilevanza della patologia non in base alla prevalenza osservata vs all’impatto di spesa potenziale | Il rischio di esclusione di prodotti innovativi in base al valore vs la prevalenza verrebbe accentuato |
| Antibiotici “reserve” |
Includere la valutazione comparativa |
L’esclusione della valutazione di una categoria rispetto introduzione privilegi acritico in contrasto con la stessa legge. |
| Malattie rare e ultra-rare | Escludere l’accettabilità della qualità delle prove molto bassa per prodotti destinati a tali patologie | Una accettazione di studi senza robustezza determina un ampliamento immotivato di innovatività, potenzialmente inesistente |
| Linee di trattamento | Escludere l’accettabilità di una valutazione acritica per ogni linea di trattamento sottomessa alla valutazione |
Rischio un ampliamento immotivato di innovatività, potenzialmente inesistente |
| Graduazione della innovatività | Introdurre elementi di distinzione precisi nella assegnazione della innovatività piena vs quella condizionata o potenziale |
Rischio di "annacquamento dei criteri di innovatività" mediante una diluizione o allentamento degli standard utilizzati ad esempio in EMA |
| Graduazione del bisogno terapeutico | Mantenimento della precedente definizione di “importanza” |
Rischio di "annacquamento dei criteri di innovatività" mediante una diluizione o allentamento degli standard |
Tali correttivi si rendono necessari per mantenere lo standard elevato raggiunto in precedenza e per evitare il rischio di un allargamento acritico del riconoscimento della innovatività, che ha l’obiettivo di estendere il finanziamento di prodotti col Fondo dedicato a:
- prodotti che tale riconoscimento esteso non dovrebbero avere
- prodotti che vengono sottomessi senza comparazione ma solo per definizione di “reserve”.
Le rappresentazioni grafiche
L’applicazione dei criteri 2017 e 2025, predisposta da AssociaLi, mette bene in evidenza l’obiettivo della modifica legislativa operata: l’estensione dell’innovatività in misura più “ampia” rispetto al passato, evidenziata in verde scuro (piena) comprendente anche quella assegnata alle malattie rare/ultrarare.
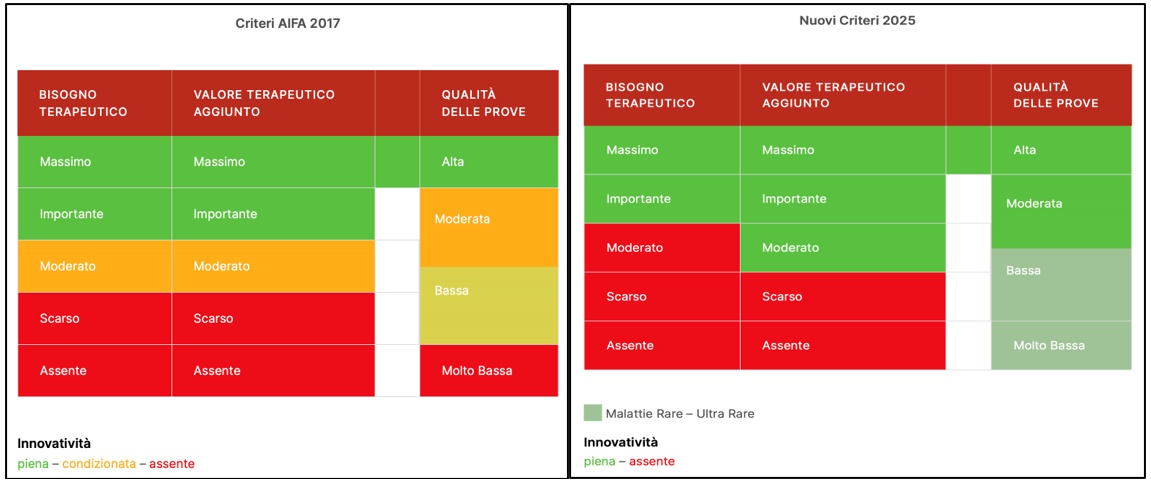
Fonte: AssociaLi, 2025. Sitoweb: https://associali.it/attribuzione-dellinnovativita-terapeutica-le-note-dellassociazione-alessandro-liberati-sulla-proposta-dellaifa/
Il contributo di SlowPharmacy
SlowPharmacy (SP) ha ritenuto di contribuire come hanno fatto singoli ed Associazioni, Regioni e Aziende alla richiesta di AIFA di consultazione pubblica terminata ad aprile, facendosi portatrice di una concezione di maggiore selettività dei criteri per evitare di “allargare” l’estensione a tutti i prodotti per i quali le imprese propongono il riconoscimento della innovatività, puntando principalmente ai benefici che vengono correlati a tale valutazione favorevole, non ultimo quello di essere inseriti nel fondo nazionale che viene messo a disposizione con legge del Parlamento.
Tale contributo di SP ( 8 è stato preceduto da un confronto interno cui hanno partecipato farmacisti del SSN, accademici ed esperti, che hanno fornito in particolare gli orientamenti sul tema ma soprattutto l’expertise specifico nell’applicazione territoriale ed ospedaliero della normativa e delle sue principali ricadute.
SP è confidente che molte delle proprie proposte siano tenute indebita considerazione da AIFA in maniera da evitare i rischi che anche noi personalmente abbiamo posto in evidenza.
Considerazioni finali
L’inquadramento fatto in premessa del progetto di modifica ai criteri per l’attribuzione del requisito di innovatività dei medicinali dà conto delle richieste presenti nel settore farmaceutico di ridurre l’impatto del payback (industriali dei dispositivi), di rimodulare i tetti di spesa (distributori intermedi) o di ampliare la remunerazione di operatori di settore (farmacisti).
Il progetto di modifica dei criteri per l’innovatività operato nella legge di bilancio 2025 mira a:
- consentire l’ingresso nel mercato “protetto” della innovazione con un fondo specifico per gli antibiotici “reserve”
- assicurare l’innovatività ai prodotti per “malattie rare e ultrarare”
- ampliare l’innovatività ai prodotti per “innovatività incrementale”.
Una revisione annacquata della valutazione della innovatività è rischiosa perché conferma la concezione della distribuzione prebendaria delle risorse alle categorie di riferimento governative e determina una riduzione di quelle che dovrebbero essere destinate alla “vera” innovazione (disruptive).
Speriamo solo che la rivisitazione del ruolo nazionale di questa valutazione che deriva dall’applicazione prossima del regolamento europeo sull’HTA delle tecnologie si traduca in una limitazione di questa distorsione “clientelare” che vorremmo considerare residuale.
* Segretario di Slow Pharmacy
Bibliografia
- Motola D, De Ponti F, Rossi P, Martini N, Montanaro N., Therapeutic innovation in the European Union: analysis ofthe drugs approved by the EMEA between 1995 and 2003, Br J. Clin Pharmacol. 2005
- Conferenza Stato-regioni del 18 novembre 2010, disponibile su http://www.statoregioni.it/Documenti/DOC_029569_197.pdf.
- Cfr. Pani L., L'innovazione sostenibile: Il farmaco e le sfide per il futuro del nostro Servizio Sanitario Nazionale, EDRA.
- GRADE – Grading of Recommendations Assessment, Development and Evaluation; http://www.jclinepi.com/content/jce-GRADE-Series), sul punto cfr anche, Puhan, MA; Schünemann, HJ; Murad, MH; Li, T; Brignardello-Petersen, R; Singh, JA; Kessels, AG; Guyatt, GH. A GRADE Working Group approach for rating the quality of treatment effect estimates from network meta-analysis, BMJ, 2014
- art.35 ter del d.l.73/2021, convertito nella l.106/2021, a far data dal 1 gennaio 2022 ha modificato l’art.1 comma 401 e seguenti della l. 232/2016.
- art.1 comma 259 della l.234/2021.
- HBR Editors. The Essential Clayton Christensen Articles. January 24, 2020. “Clayton M. Christensen è noto soprattutto per la sua teoria del l'innovazione dirompente, nella quale mette in guardia le grandi aziende consolidate dal pericolo di diventare troppo brave in ciò che fanno meglio. Per far crescere i margini di profitto e le entrate, osserva, tali società tendono a sviluppare prodotti che soddisfino le esigenze dei loro clienti più sofisticati. Per quanto questa strategia possa avere successo, ciò significa che queste aziende tendono anche a ignorare le opportunità di soddisfare le esigenze dei clienti meno sofisticati - che alla fine possono formare mercati molto più grandi. Un nuovo arrivato può quindi introdurre un prodotto più semplice, più economico e quindi più diffuso "innovazione dirompente". Attraverso l'innovazione incrementale, il prodotto viene raffinato e si sposta verso il mercato di fascia alta, completando la rottura del l'azienda originale. Sitoweb: https://hbr.org/2020/01/the-essential-clayton-christensen-articles
- SlowPharmacy. Consultazione pubblica AIFA sui criteri di attribuzione dell’innovatività terapeutica: la posizione di Slow Pharmacy. Sitoweb: https://www.slowpharmacy.it/joomla4/images/pdf/Aifa_criteri_innovativita_slowpharmacy.pdf
